
���¶�t ���£�ijBa(OH)2��ϡ��Һ��c(H+)=10-amol/L��c(OH-)=10-bmol/L����֪a+b=12��
�����Һ����μ���pH=b�����ᣬ��û����Һ�IJ���pH���±���ʾ��
| ��� | �������������/mL | ��������/mL | ��Һ��pH |
| �� | 22.00 | 0.00 | 8 |
| �� | 22.00 | 18.00 | 7 |
| �� | 22.00 | 22.00 | 6 |
(1)���������жϣ�t ��____25��(����ڡ�����С�ڡ����ڡ�)�����¶���ˮ�����ӻ�Kw=_____��
(2)b=____________��ԭBa(OH)2��ϡ��Һ�����ʵ���Ũ��Ϊ_____________��
(3)���¶��£���1L�����������ƵĻ����Һ�м���3L��Ba(OH)2��ϡ��Һʱ���������ô�
���������������Һ��ȡ��4mL����ˮϡ����20mL�������Һ��pHΪ7����ԭ����������
�ƻ����Һ��pHΪ_________���Լ�����Na2SO4�����ʵ���Ũ��Ϊ_________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ӱ��ӵ��Ҵ���Һ�з��뱽�Ӻ��Ҵ��������в�����
�ٹ��� ������ �۾��÷�Һ
�ܼ��������Ľ����� �ݼ���������NaOH��Һ ��ͨ������Ķ�����̼
����������FeCl3 ��Һ �����������Ũ������Һ���ȡ�
������ʵ��������輰˳���ǣ� ��
A. �ܢݢ� B. �ޢ٢ݢ� C. ��٢ߢ� D. �ݢڢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�������£���3 molA��1 molB�����������ڹ̶��ݻ�Ϊ2 L���ܱ������У��������·�Ӧ��3A��g��+B��g�� x C��g��+ 2D��g����2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8molD,�����C��Ũ��Ϊ0.2mol��L
x C��g��+ 2D��g����2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8molD,�����C��Ũ��Ϊ0.2mol��L �����ж���ȷ����
�����ж���ȷ����
A��B��ת����Ϊ80��
B��A��ƽ����Ӧ����Ϊ0.6mol��(L��min)
C����ʱ������0.2molC��0.4molD����C���������������
D����ʱ���ټ���1molB����ƽ��ʱ��A��ת���ʽ���B��2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ͭ�Ļ�������ϡ�����У���ַ�Ӧ�������ʣ�࣬Ȼ����ˣ����˳��Ĺ�������Ͷ��������������ų�������Һ��һ�����еĽ������ǣ� ��
A��Cu(NO3)2 B��Fe(NO3)3 C��Fe(NO3)2 D��Fe(NO3)2��Cu(NO3)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1 mol A(g)��2 mol B(g)����2Lij�ܱ������У���һ���¶��·�����Ӧ��
A(g)+B(g)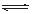 C(g)+D(g)�����ﵽƽ�⡣C�����������ʱ��仯����ͼI������b��ʾ����Ӧ�����е������仯��ͼII��ʾ������˵������ȷ���ǣ� ��
C(g)+D(g)�����ﵽƽ�⡣C�����������ʱ��仯����ͼI������b��ʾ����Ӧ�����е������仯��ͼII��ʾ������˵������ȷ���ǣ� ��
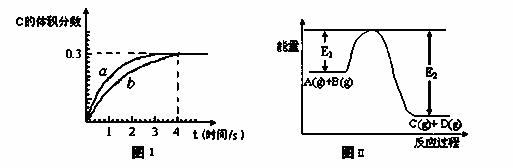
A����������Ӧ��ϵ�м����������ѧ��Ӧ��������E1��E2����С
B�����¶��£���Ӧ��ƽ�ⳣ����ֵԼΪ7.36
C�����������£���С��Ӧ�����������ʹ��Ӧ �Ĺ��̰�ͼI��a���߽���
D����Ӧ�ڵ�4���Ӵﵽ��ѧƽ��״̬��0��4���ڣ���A��ʾ�Ļ�ѧ��Ӧ������0.225mol��L-1��s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и�����Һ�У��ܴ����������ɫ���������飨 ��
A��PH=0����Һ�� Fe2+ ��NO3-��SO42-��I-
B��C(H+)=10-14mol�� L-1����Һ�У�Na+ ��[Al��OH��4]����S2����SO32��
C�����Ի����£� Na+�� ��Cu2+�� NO3-�� SO42-��
D��ʹ��ɫʯ����Һ������Һ�У�K+ ��Na+ ��Ca2+ ��HCO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������������п���֤������������ʵ���( )
A. 1 mol��L��1�ļ�����Һ��c��H����ԼΪ0.01 mol��L��1
B. ������ˮ�������������
C. 10 mL 1 mol��L��1����ǡ����10 mL 1 mol��L��1NaOH��Һ��ȫ��Ӧ
D. ������Һ�ĵ����Ա�������Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ʵ���������ж�Ԫ�ؽ�����ǿ�����ǣ� ��
A��1 mol���������ڷ�Ӧ��ʧȥ���ӵĶ���
B����������֮�䷢�����û���Ӧ
C������Ԫ������������Ӧ��ˮ����ļ���ǿ��
D������Ԫ�صĵ�����ˮ�����û������������׳̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����a mol FeBr2����Һ�У�ͨ��x mol Cl2�� ���и���ΪͨCl2�����У���Һ�ڷ�����Ӧ�����ӷ���ʽ����������ȷ����
A��x��0.4a��2Fe2++Cl2��2Fe3++2Cl��
B��x��0.6a��2Br��+ Cl2��Br2+2Cl��
C��x=a��2Fe2��+2Br��+2Cl2��Br2+2Fe3��+4Cl��
D��x=1.5a��2Fe2��+4Br��+3Cl2��2Br2+2Fe3��+6Cl��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com