
| 族 |
I A | II A | III A | IV A | V A | VI A | VII A |
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | 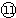 |
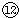 |
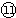 的氢化物的还原性
的氢化物的还原性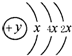 ,在周期表位于
,在周期表位于 与⑧形成化合物形成过程:
与⑧形成化合物形成过程: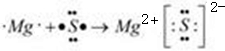
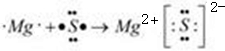
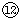 的最高价氧化物对应水化物反应的离子方程式:⑦与⑨:
的最高价氧化物对应水化物反应的离子方程式:⑦与⑨: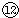
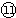 为S,非金属性越强,则对应离子的还原性越弱,气态氢化物越稳定;
为S,非金属性越强,则对应离子的还原性越弱,气态氢化物越稳定;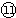 为S,⑧为Mg,形成的化合物为离子化合物;
为S,⑧为Mg,形成的化合物为离子化合物;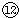 为Cl,然后利用酸碱之间的反应来分析.
为Cl,然后利用酸碱之间的反应来分析.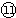 为S,非金属性S>P,则还原性PH3>H2S,气态氢化物H2S>PH3,故答案为:PH3;强;弱;
为S,非金属性S>P,则还原性PH3>H2S,气态氢化物H2S>PH3,故答案为:PH3;强;弱;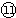 为S,⑧为Mg,形成的化合物为离子化合物,其形成过程为
为S,⑧为Mg,形成的化合物为离子化合物,其形成过程为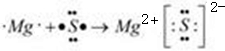 ,故答案为:
,故答案为: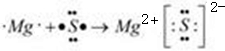 ;
;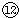 为Cl,NaOH与Al(OH)3反应的离子反应为OH-+Al(OH)3═AlO2-+2H2O,HClO4与Al(OH)3反应的离子反应为3H++Al(OH)3═Al3++3H2O,
为Cl,NaOH与Al(OH)3反应的离子反应为OH-+Al(OH)3═AlO2-+2H2O,HClO4与Al(OH)3反应的离子反应为3H++Al(OH)3═Al3++3H2O,

科目:高中化学 来源: 题型:
| H | He | ||||||
| A | B | ||||||
| C | D | E | F | G |
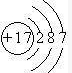



查看答案和解析>>
科目:高中化学 来源: 题型:
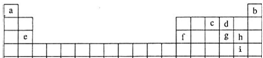
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
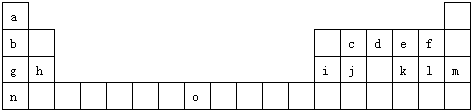
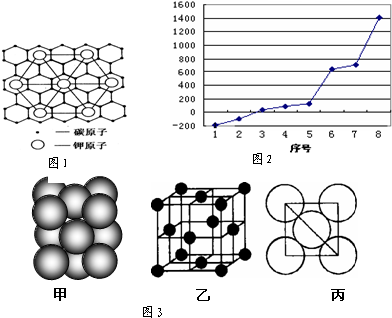
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | A | ||||||
| 2 | B | C | D | E | J | K | L |
| 3 | F | G | H | I | |||
| M |
 它的空间利用率为
它的空间利用率为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com