
����Ŀ��[ѡ��3�����ʽṹ������]
��1��19-�� ����������ȷ���У� ��
A.ijԪ��ԭ�Ӻ�����������������ѧ@������������5���������������Ϊ+7
B.��Ԫ�صĵ�һ���ڶ������ֱܷ�С��þԪ�صĵ�һ���ڶ�������
C.������������������Ծ����ڴ���������Ժ�������
D.���ǻ�����ȩ���۵���ڶ��ǻ�����ȩ���۵�
��2��19-�� ��A��Ԫ�ؼ��仯�����ڲ��ϵȷ�������Ҫ��;���ش��������⣺
1��̼��һ�ֵ��ʵĽṹ��ͼ��a����ʾ���õ��ʵľ�������Ϊ �� ԭ�Ӽ���ڵĹ��ۼ������� �� ̼ԭ�ӵ��ӻ��������Ϊ��


2��SiCl4���ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ �� ���ӵ����幹��Ϊ �� �������ӣ�����ԡ��Ǽ��ԡ�����
3����±����SiX4�ķе�Ͷ�±��ǦPbX2���۵���ͼ��b����ʾ��
��SiX4�ķе���F��Cl��Br��I�������ߵ�ԭ������
�ڽ��SiX4�ķе��PbX2���۵�ı仯���ɣ����ƶϣ���F��Cl��Br��I����PbX2�еĻ�ѧ�������������������������ǿ�������䡱��������
4��̼����һ�ֵ���C60��������γɵ��³������������ṹ��ͼ��c����ʾ��Kλ������������Ϻ���������ڲ����˻�����Ļ�ѧʽΪ���侧������Ϊ1.4 nm�������ܶ�Ϊ
g��cm-3��
���𰸡�
��1��AD
��2����Ͼ��壻�Ҽ����м���sp2��4���������壻�Ǽ��ԣ�SiX4���ڷ��Ӿ��壬��Է�������Խ�е�Խ�ߣ���������ǿ��K3C60��2.0
��������(1) �⣺A��ijԪ��ԭ�Ӻ������������������������5�������Ԫ��ΪBr�����������Ϊ+7����A��ȷ�� B��ͬһ����Ԫ�أ�Ԫ�صĵ�һ����������ԭ��������������������ƣ���IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ���NaԪ�ص�һ������С��MgԪ�أ�����NaԪ�صڶ������ܴ���MgԪ�أ���Ϊ��ʱ��������ȫ��Ϊ�ȶ��ṹ����B����
C��HClO�е�+1�����ȶ��Ա�HClO4�е�+7���Ȳ�����õ��ӣ��������Դ�������ڸ����ᣬ��C����
D�����ǻ�����ȩ�� ![]() �����γɷ�������������ǻ�����ȩ��
�����γɷ�������������ǻ�����ȩ�� ![]() �����γɷ��Ӽ�������γɷ��Ӽ�����ʱ�е�ϸߣ��γɷ����ڵ����ʱ�е�ϵͣ��������ǻ�����ȩ���۵���ڶ��ǻ�����ȩ����D��ȷ��
�����γɷ��Ӽ�������γɷ��Ӽ�����ʱ�е�ϸߣ��γɷ����ڵ����ʱ�е�ϵͣ��������ǻ�����ȩ���۵���ڶ��ǻ�����ȩ����D��ȷ��
��ѡAD��(2) �⣺1��̼��һ�ֵ��ʵĽṹ��ͼ��a����ʾ��ӦΪʯī�����ڻ���;��壬��ʯī�����У�ͬ���ÿһ��̼ԭ����sp2�ӻ���������ڵ�����̼ԭ���ԦҼ���ϣ�����̼ԭ����ͬһ��ƽ�����γ����������εĻ�����չ��Ƭ��ṹ����ͬһƽ���̼ԭ�ӻ���ʣ��һ��p�����������һ��2p���ӣ���Щp����ֶ�����ƽ�У�����ֱ��̼ԭ��sp2�ӻ�������ɵ�ƽ�棬�γ��˴�м������Դ��ǣ���Ͼ��壻�Ҽ����м���sp2��2��SiCl4���ӵ�����ԭ��ΪSi���γ�4���Ҽ����۲���Ӷ���Ϊ4��������������ṹ�����ڷǼ��Է��ӣ����Դ��ǣ�4���������壻�Ǽ��ԣ�3������±����ķе������ߣ�Ϊ���Ӿ��壬�е�����Է��������йأ���Է�������Խ�е�Խ�ߣ�
���Դ��ǣ�SiX4���ڷ��Ӿ��壬��Է�������Խ�е�Խ�ߣ�
��PbX2�ķе����ͣ�����PbF2Ϊ���Ӿ��壬PbBr2��PbI2Ϊ���Ӿ��壬��֪��F��Cl��Br��I����PbX2�еĻ�ѧ���������Լ�������������ǿ��
���Դ��ǣ���������ǿ��4��Kλ��������ģ������еĸ���Ϊ12�� ![]() +9=12��C60λ�ڶ�������ģ�����Ϊ8��
+9=12��C60λ�ڶ�������ģ�����Ϊ8�� ![]() +6��
+6�� ![]() =4����ѧʽΪK3C60 �� ��������Ϊ
=4����ѧʽΪK3C60 �� ��������Ϊ ![]() g���侧������Ϊ1.4nm=1.4��10��7cm�������Ϊ��1.4��10��7��3cm3 �� �����ܶ�Ϊ
g���侧������Ϊ1.4nm=1.4��10��7cm�������Ϊ��1.4��10��7��3cm3 �� �����ܶ�Ϊ 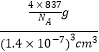 =2.0gcm��3 ��
=2.0gcm��3 ��
���Դ��ǣ�K3C60��2.0��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����4gNH3�к���x��NH3���ӣ���ô8gH2S�к��еĵ�����Ϊ
A.xB.3.4xC.12xD.18x
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҽ�����黼��״���״�IJ��˶�Ժ������������ں����к��Ϸḻ�ģ� ��
A.��Ԫ��
B.��Ԫ��
C.��Ԫ��
D.пԪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƫ�����£�C2H8N2����һ�ָ���ȼ�ϣ�ȼ�ղ����ľ���������Ϊ�������ػ�����ƶ���������������ȷ���ǣ�������
A. ƫ�����µ�Ħ������Ϊ60 g B. 1 mol ƫ�����µ�����Ϊ60 g/mol
C. 1molƫ�����µ�����Ϊ60 g D. 6 gƫ�����£�C2H8N2������NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[ѡ��5���л���ѧ����]
��1��18-��.
��éȩ�� ![]() ������Ϊ�ϳ������ص��м��壬������éȩ��������ȷ���У� ��
������Ϊ�ϳ������ص��м��壬������éȩ��������ȷ���У� ��
A.����ʽΪC10H18O
B.���ܷ���������Ӧ
C.��ʹ����KMnO4��Һ��ɫ
D.��������7�ֲ�ͬ��ѧ��������
��2��18-��.
���Ѽ����˵��������ͬʱ��R1��O��R2 �� R1��R2����ͨ������Ϊ�����ѡ������ô���ˮ�ij��淽���Ʊ����ѣ����������ั���
R1��OH+ R2��OH ![]() R1��O��R2+ R1��O��R1+ R2��O��R2+H2O
R1��O��R2+ R1��O��R1+ R2��O��R2+H2O
һ����Williamson��Ӧ�Ʊ����ѣ�R1��X+ R2��ONa��R1��O��R2+NaX��ij�����о�С����ϳ� ![]() ���һ��л��ѣ���������������·�߽��жԱȣ�
���һ��л��ѣ���������������·�߽��жԱȣ�
�� ![]()
�� ![]()
�� ![]()
�� ![]()
�ش��������⣺
1��·�ߢ����Ҫ������������
2��A�Ľṹ��ʽΪ��
3��B���Ʊ�������Ӧע��İ�ȫ��������
4����A��B�����һ��л��ѵķ�Ӧ����Ϊ��
5���Ƚ������ϳ�·�ߵ���ȱ�㣺��
6�����״���ͬ���칹���к��б����Ļ����֡�
7��ijͬѧ�ø�Ϊ�����õļױ�������״��ϳ��һ��л��ѣ������·�ߢ�д���ϳ�·����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��̻�����������ˮ���ص���
A.������Һȥ����B.���ڳ�ʪ�Ļ���������
C.�����Ȼ�����Һ��ɫ����D.������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�� W��X��Y��Zԭ��������������W��Y��X��Zλ��ͬһ���壬W��X���γɹ��ۻ����� WX2��Yԭ���ڲ������������������������2.5����������������ȷ���ǣ� ��
A. WX��WX2��ZX2�Ļ�ѧ��������ȫ��ͬ
B. WZ2����������ԭ������㶼����8���ӽṹ
C. ����X�ij����⻯�H2X�����Ӽ�����������H2X��H2Z �ȶ�
D. ԭ�Ӱ뾶��С˳��ΪX<W<Z<Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У������������ᣨ�ף�Ka=1.8��10-5����һ�����ᣨ�ң�Ka=1.4��10-3����ˮ�еĵ������Ũ�ȹ�ϵ���ǣ� ��
A.
B.
C.
D.
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com