


| A����С��Ӧ���ݻ� | B������Fe�����ʵ��� |
| C�������¶ȵ�900�� | D��ʹ�ú��ʵĴ��� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 SO3(g) K1,CO(g)+1/2O2(g)
SO3(g) K1,CO(g)+1/2O2(g)  CO2(g) K2������ͬ�¶��·�ӦSO2(g)+CO2(g)
CO2(g) K2������ͬ�¶��·�ӦSO2(g)+CO2(g)  SO3(g)+CO(g)��ƽ�ⳣ��Ϊ ��
SO3(g)+CO(g)��ƽ�ⳣ��Ϊ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3(g) ��H����ͼI�Ǻϳɰ���Ӧ�������뷴Ӧ�������ͼ��δʹ�ô�������ͼD�Ǻϳɚݷ�Ӧ��2L�����С���ͬͶ������¡���������������ʱ��ijһ��Ӧ�����ĸı�Է�Ӧ��Ӱ��ͼ��
2NH3(g) ��H����ͼI�Ǻϳɰ���Ӧ�������뷴Ӧ�������ͼ��δʹ�ô�������ͼD�Ǻϳɚݷ�Ӧ��2L�����С���ͬͶ������¡���������������ʱ��ijһ��Ӧ�����ĸı�Է�Ӧ��Ӱ��ͼ��
| A����H����92.4kJ/mol |
| B��ʹ�ô�����ʹE1����ֵ���� |
| C��Ϊ�����ת���ʣ���ҵ�����з�Ӧ��Ũ��Խ��Խ�� |
| D��ͼII�Dz�ͬѹǿ�·�Ӧ��ϵ�а������ʵ����뷴Ӧʱ���ϵͼ����PA<PB |
 mol/(L��min)
mol/(L��min) ��������¶��µ�ƽ�ⳣ��Ϊ_______����ͬһ�¶ȣ�ͬһ�����У�����ʼ���ʸ�Ϊamol N2 b molH2 c mol NH3 (a,b,c����Ϊ�㣩��ʹƽ�������и����ʵ�������ԭƽ����ͬ����a,b,c����Ĺ�ϵΪ_____________(�ú�a,b,c�ı���ʽ��ʾ��������ʹ��Ӧ����ʼʱ���淴Ӧ������У�c��ȡֵ��Χ��_______
��������¶��µ�ƽ�ⳣ��Ϊ_______����ͬһ�¶ȣ�ͬһ�����У�����ʼ���ʸ�Ϊamol N2 b molH2 c mol NH3 (a,b,c����Ϊ�㣩��ʹƽ�������и����ʵ�������ԭƽ����ͬ����a,b,c����Ĺ�ϵΪ_____________(�ú�a,b,c�ı���ʽ��ʾ��������ʹ��Ӧ����ʼʱ���淴Ӧ������У�c��ȡֵ��Χ��_______�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������

 CH3OH(g) ��H��QkJ/mol
CH3OH(g) ��H��QkJ/mol ( CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ������ͼ2��ʾ����������Ӧ��Q_____0���������������������
( CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ������ͼ2��ʾ����������Ӧ��Q_____0����������������������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
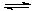 H++ SO42-
H++ SO42- �ķ�ˮ�ᷢ�����·�Ӧ��
�ķ�ˮ�ᷢ�����·�Ӧ��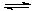 Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+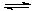 Mg2+ +2NH3��H2O��
Mg2+ +2NH3��H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2Fe��s��+3CO2��g�� ��H= ��28��5 kJ����mol��1
2Fe��s��+3CO2��g�� ��H= ��28��5 kJ����mol��1 2CO��g�� ��H=" +" 172��5 kJ��mol��1
2CO��g�� ��H=" +" 172��5 kJ��mol��1 2Fe��s��+3CO��g�� ��H= kJ��mol��1
2Fe��s��+3CO��g�� ��H= kJ��mol��1 2Fe��s��+3CO2��g�� ��H=��28��5 kJ��mol��1��ƽ�ⳣ������ʽK= ���¶Ƚ��ͺ�Kֵ ��������������䡱��С������
2Fe��s��+3CO2��g�� ��H=��28��5 kJ��mol��1��ƽ�ⳣ������ʽK= ���¶Ƚ��ͺ�Kֵ ��������������䡱��С������| | Fe2 O3 | CO | Fe | CO2 |
| ������ | 1��0 mol | 1��0 mol | 1��0 mol | 1��0 mol |
| ������ | 1��0 mol | 2��0 mol | 1��0 mol | 1��0 mol |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3(g) ?H=-196��6 kJ��mol-1
2SO3(g) ?H=-196��6 kJ��mol-1 2NO2(g) ?H=-113��0 kJ��mol-1
2NO2(g) ?H=-113��0 kJ��mol-1  SO3(g)+NO(g)��?H= kJ��mol-1��
SO3(g)+NO(g)��?H= kJ��mol-1��

 CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ���ң���ʾ���÷�Ӧ?H 0���>���� <������
CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ���ң���ʾ���÷�Ӧ?H 0���>���� <������ �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 CH3CH2OH(g) + H2O(g) ��H =" ��256.1" kJ��mol��1
CH3CH2OH(g) + H2O(g) ��H =" ��256.1" kJ��mol��1 CO2(g)+H2(g) ��H=" ��41.2" kJ��mol��1
CO2(g)+H2(g) ��H=" ��41.2" kJ��mol��1 CH3CH2OH(g) +3H2O(g) ��H = ��
CH3CH2OH(g) +3H2O(g) ��H = ��
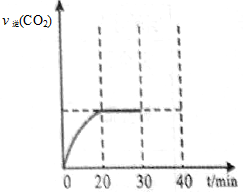
 N2 (g) + CO2 (g)��ij�о�С����ij�ܱ������м��������Ļ���̿��NO������( T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2 (g) + CO2 (g)��ij�о�С����ij�ܱ������м��������Ļ���̿��NO������( T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�| �� Ũ��/mol?L��1 ʱ��/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3�������仯��ͼ��ʾ��
2NH3�������仯��ͼ��ʾ��
 N2(g)+
N2(g)+ H2(g)
H2(g)  NH3(g ) ��H= ��
NH3(g ) ��H= ���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com