
 2NH3(g) ��H����ͼI�Ǻϳɰ���Ӧ�������뷴Ӧ�������ͼ��δʹ�ô�������ͼD�Ǻϳɚݷ�Ӧ��2L�����С���ͬͶ������¡���������������ʱ��ijһ��Ӧ�����ĸı�Է�Ӧ��Ӱ��ͼ��
2NH3(g) ��H����ͼI�Ǻϳɰ���Ӧ�������뷴Ӧ�������ͼ��δʹ�ô�������ͼD�Ǻϳɚݷ�Ӧ��2L�����С���ͬͶ������¡���������������ʱ��ijһ��Ӧ�����ĸı�Է�Ӧ��Ӱ��ͼ��
| A����H����92.4kJ/mol |
| B��ʹ�ô�����ʹE1����ֵ���� |
| C��Ϊ�����ת���ʣ���ҵ�����з�Ӧ��Ũ��Խ��Խ�� |
| D��ͼII�Dz�ͬѹǿ�·�Ӧ��ϵ�а������ʵ����뷴Ӧʱ���ϵͼ����PA<PB |
 mol/(L��min)
mol/(L��min) ��������¶��µ�ƽ�ⳣ��Ϊ_______����ͬһ�¶ȣ�ͬһ�����У�����ʼ���ʸ�Ϊamol N2 b molH2 c mol NH3 (a,b,c����Ϊ�㣩��ʹƽ�������и����ʵ�������ԭƽ����ͬ����a,b,c����Ĺ�ϵΪ_____________(�ú�a,b,c�ı���ʽ��ʾ��������ʹ��Ӧ����ʼʱ���淴Ӧ������У�c��ȡֵ��Χ��_______
��������¶��µ�ƽ�ⳣ��Ϊ_______����ͬһ�¶ȣ�ͬһ�����У�����ʼ���ʸ�Ϊamol N2 b molH2 c mol NH3 (a,b,c����Ϊ�㣩��ʹƽ�������и����ʵ�������ԭƽ����ͬ����a,b,c����Ĺ�ϵΪ_____________(�ú�a,b,c�ı���ʽ��ʾ��������ʹ��Ӧ����ʼʱ���淴Ӧ������У�c��ȡֵ��Χ��_______ CaCl2��2NH3����2H2O��2�֣� ��2��AEFG ��2�֣�
CaCl2��2NH3����2H2O��2�֣� ��2��AEFG ��2�֣� O2(g)��
O2(g)�� H2O(l)��
H2O(l)�� N2(g) ��H����382.5kJ/mol��2�֣�
N2(g) ��H����382.5kJ/mol��2�֣� CaCl2��2NH3����2H2O��
CaCl2��2NH3����2H2O�� mol/(L��min)��G��ȷ����ѡAEFG��
mol/(L��min)��G��ȷ����ѡAEFG�� 2NH3(g)
2NH3(g) ��
�� ��4.5��1��x��3.5��3x��2x
��4.5��1��x��3.5��3x��2x ��
�� ��0.25L2��mol��2
��0.25L2��mol��2 2NH3(g) ��H����92.4kJ/mol���ڿ�֪���ڡ�2���١�
2NH3(g) ��H����92.4kJ/mol���ڿ�֪���ڡ�2���١� ���õ��Ȼ�ѧ����ʽNH3(g)��
���õ��Ȼ�ѧ����ʽNH3(g)�� O2(g)��
O2(g)�� H2O(l)��
H2O(l)�� N2(g) ��H����382.5kJ/mol��ԭ��ظ���ʧȥ���ӣ�����������Ӧ�������õ����ӣ�������ԭ��Ӧ�������ڸ�ȼ�ϵ���а���ʧȥ���ӣ��ڸ���ͨ�룬��缫��Ӧʽ��2NH3��6e����6OH����6H2O��N2�����Ȼ�ѧ����ʽ��֪��ÿ����1molN2�ų�765kJ��������ʵ���ṩ460kJ�ĵ��ܣ����Ը�ȼ�ϵ�ص�ʵ��Ч��Ϊ
N2(g) ��H����382.5kJ/mol��ԭ��ظ���ʧȥ���ӣ�����������Ӧ�������õ����ӣ�������ԭ��Ӧ�������ڸ�ȼ�ϵ���а���ʧȥ���ӣ��ڸ���ͨ�룬��缫��Ӧʽ��2NH3��6e����6OH����6H2O��N2�����Ȼ�ѧ����ʽ��֪��ÿ����1molN2�ų�765kJ��������ʵ���ṩ460kJ�ĵ��ܣ����Ը�ȼ�ϵ�ص�ʵ��Ч��Ϊ ��100%��60.1%��
��100%��60.1%��

 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3(g)��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��
2SO3(g)��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ�� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ���ķ�Ӧ�Ȧ�HΪ �� ��
���ķ�Ӧ�Ȧ�HΪ �� ��| A��-1780kJ��mol��1 | B��-1220kJ��mol��1 | C��-450kJ��mol��1 | D��+430kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH��g������H=-90.8kJ��mol��1
CH3OH��g������H=-90.8kJ��mol��1 CH3OCH3��g��+H2O��g������H=-23.5kJ��mol��1
CH3OCH3��g��+H2O��g������H=-23.5kJ��mol��1 CO2��g��+H2��g������H=-41.3kJ��mol��1
CO2��g��+H2��g������H=-41.3kJ��mol��1 CH3OCH3��g��+CO2��g���ġ�H= ��
CH3OCH3��g��+CO2��g���ġ�H= ��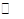 CH3OCH3��g��+H2O(g)ij�¶��µ�ƽ�ⳣ��Ϊ400��
CH3OCH3��g��+H2O(g)ij�¶��µ�ƽ�ⳣ��Ϊ400��| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/��mol?L�� | 0.44 | 0.6 | 0.6 |
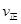 _______
_______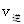 ���>������<����=������
���>������<����=�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��-335.7 kJ��mol��1 | B��-16.3 kJ��mol��1 |
| C��+16.3 kJ��mol��1 | D��-83.7 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 O2(g)=HNO2(aq)+H+(aq)+H2O(1) ��H="-b" KJ/mol
O2(g)=HNO2(aq)+H+(aq)+H2O(1) ��H="-b" KJ/mol| A����NH4+ת��ΪNO3-���Ȼ�ѧ����ʽ�ɱ�ʾΪ�� NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1)��H=-(b+  )KJ/mol )KJ/mol |
| B������������ת�������У���ˮ������������Ȼ������ |
| C�������£���HNO3��Һ��c(H+)="0.1" mol��L-1�������Һ��pH>1 |
| D������������ת����ȫ�������������������ӵĴ��ڣ���c(NH4+)+c(OH-)=c(NO3-)+c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 2NH3 (g) ��H<0��
2NH3 (g) ��H<0��| T /K | 298 | 398 |
| ƽ�ⳣ��K | K1 | K2 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������


| A����С��Ӧ���ݻ� | B������Fe�����ʵ��� |
| C�������¶ȵ�900�� | D��ʹ�ú��ʵĴ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
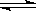 2SO3(g) ��һ�������´ﵽƽ�⣬���c(SO3)=0.040mol/L����������·�Ӧ��ƽ�ⳣ��K����ֵΪ___________,SO2��ƽ��ת����Ϊ__________��
2SO3(g) ��һ�������´ﵽƽ�⣬���c(SO3)=0.040mol/L����������·�Ӧ��ƽ�ⳣ��K����ֵΪ___________,SO2��ƽ��ת����Ϊ__________��| A����ƽ�������г���Ar | B����ƽ�������г���O2 |
| C���ı䷴Ӧ�Ĵ��� | D�����ͷ�Ӧ���¶� |
 2SO3(g) ��H<0 �� SO2��ת��������ʼ�¶�T1=673K���淴Ӧʱ�䣨t���ı仯����ͼ�������������䣬���ı���ʼ�¶�ΪT2=723K������ͼ�л����¶�T2��SO2��ת�����淴Ӧʱ��仯��Ԥ�ڽ��ʾ��ͼ��
2SO3(g) ��H<0 �� SO2��ת��������ʼ�¶�T1=673K���淴Ӧʱ�䣨t���ı仯����ͼ�������������䣬���ı���ʼ�¶�ΪT2=723K������ͼ�л����¶�T2��SO2��ת�����淴Ӧʱ��仯��Ԥ�ڽ��ʾ��ͼ��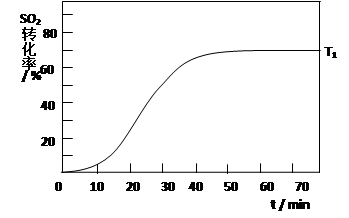
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com