
(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是________。
(2)已知某粒子的结构示意图为
试回答:
①当x-y=10时,该粒子为________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,粒子可能为(填名称)________、________、________、________、________。
③写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式__________________________。
科目:高中化学 来源: 题型:填空题
D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体形、三角锥形、正四面体形、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为 。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是 ,写出该元素的任意3种含氧酸的化学式: 、 、 。
(3)D和Y形成的化合物分子的空间构型为 。
(4)D和X形成的化合物的化学键类型是 ,其晶体类型是 。
(5)试比较D和X的最高价氧化物熔点的高低并说明理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按照下列元素基态原子的电子排布特征判断元素,并回答问题:A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)A~E分别是哪种元素(用元素符号填空):
A:__________;B:________;C:__________;D:________;E:________。
(2)E的原子结构示意图________________。
(3)C的轨道表示式____________________。
(4)B原子的核外电子排布式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷的目的。人们曾采用乙醚、NH3、CH3Cl等作制冷制,但它们不是有毒就是易燃,于是科学家根据元素性质的递变规律来开发新的制冷剂。根据已有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:
SiH4>PH3>H2S>HCl,则________>________>H2O>HF(填物质的化学式)。
(2)化合物的毒性:
PH3>NH3,CCl4>CF4,则H2S________H2O,CS2________CO2(填“>”“=”或“<”)。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8 ℃,CF4的沸点为-128 ℃,新的制冷剂的沸点范围应介于二者之间,经过较长时间的反复实验,发现了制冷剂CF2Cl2(氟利昂),其他类似的制冷剂可以是________。
(4)然而这种制冷剂造成的当今某一环境问题是_____________________________。
但求助于周期表中元素及其化合物的______(填写下列选项的编号)变化趋势开发制冷剂的科学思维方法是值得借鉴的。
①毒性;②沸点;③易燃性;④水溶性;⑤颜色
| A.①②③ | B.②④⑤ | C.②③④ | D.①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位于第________周期;乙元素在周期表中位于第________族;丙元素的名称为________。
(2)甲的单质与水反应的离子方程式为____________________________;
乙单质与丙单质反应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碳及其化合物应用广泛。
I.工业上利用CO和水蒸汽反应制氢气,存在以下平衡:CO(g)+H2O(g) 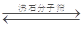 CO2(g)+H2(g)
CO2(g)+H2(g)
(1)沸石分子筛中含有硅元素,请写出硅原子结构示意图__________。
(2)向1L恒容密闭容器中注人CO和H2o(g),830℃时测得部分数据如下表。则该温度下反应的平衡常
数K=______________。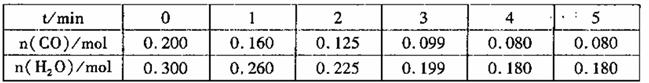
(3)相同条件下,向1L恒容密闭容器中,同时注人1mol CO、1mol H2O(g),2molCO2和2mo1 H2,此时v(正 ) __________v(逆)(填“>”“=”或“<”)
II.已知CO(g)+1/2 O2 (g)=CO2 (g) △H=一141 kJ·mol-1
2H2(g)+ O2(g)=2H2O(g) △H=一484 kJ·mol-1
CH3OH(1)+3/2O2 (g)=CO2(g)+2H2O(g) △Hl=一726 kJ·mol-1
(4)利用CO、H2化合制得液态甲醇的热化学方程式为___________。
III.一种新型氢氧燃料电池工作原理如下图所示
(5)写出电极A的电极反应式_____________。
(6)以上述电池电解饱和食盐水,若生成0.2mo1 Cl2,则至少需通人O2的体积为_____L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)X、Y、Z是短周期三种元素,它们在周期表中的位置如图所示。试回答:
| | | X |
| | Y | |
| Z | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是________(用元素符号表示)。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,A的电子式为________,B的结构式为________。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________,该族二~五周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________(填字母代号)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1
c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式:_________________________________________________________________________;由R生成Q的化学方程式为____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com