
分析 (1)K4[Fe(CN)6]会发生分解生成KCN、C、N2和灰白色固体化合物甲,甲在足量氧气中灼烧得到红棕色固体乙为Fe2O3,生成二氧化碳为0.1mol,则18g甲中含有碳原子为0.1mol,含有Fe的质量为18g-0.1mol×12g/mol=15.8g,Fe原子物质的量为$\frac{15.8g}{56g/mol}$=0.3mol,故甲的化学式为Fe3C;
(2)亚铁氰化钾与稀硫酸共热会发生非氧化还原反应,并产生一种常见的含氧还原性有毒气体,该气体为CO,还生成硫酸亚铁、硫酸钾、硫酸铵;
(3)乙应用还原性混合气体反应得到Fe3C;
(4)甲也可由某单质与甲烷高温下生成,应是Fe与甲烷反应生成Fe3C与氢气;
(5)HCN气体用碳酸钾溶液在填充铁粉的塔内循环吸收,生成亚铁氰化钾,同时还产生两种常见气体为氢气、二氧化碳;
(6)利用铁粉、稀硫酸、双氧水制备硫酸铁溶液,再利用K4Fe(CN)6与Fe3+产生蓝色沉淀进行检验.
解答 解:(1)K4[Fe(CN)6]会发生分解生成KCN、C、N2和灰白色固体化合物甲,甲在足量氧气中灼烧得到红棕色固体乙为Fe2O3,生成二氧化碳为0.1mol,则18g甲中含有碳原子为0.1mol,含有Fe的质量为18g-0.1mol×12g/mol=15.8g,Fe原子物质的量为$\frac{15.8g}{56g/mol}$=0.3mol,故甲的化学式为Fe3C,
故答案为:Fe3C;
(2)亚铁氰化钾与稀硫酸共热会发生非氧化还原反应,并产生一种常见的含氧还原性有毒气体,该气体为CO,还生成硫酸亚铁、硫酸钾、硫酸铵,反应离子方程式为:[Fe(CN)6]4-+12H++6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2++6NH4++6CO↑,
故答案为:[Fe(CN)6]4-+12H++6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2++6NH4++6CO↑;
(3)乙应用还原性混合气体反应得到Fe3C,A、D选项中CO、氢气具有还原性,B、C选项中均不能可以,
故选:BC;
(4)甲也可由某单质与甲烷高温下生成,应是Fe与甲烷反应生成Fe3C与氢气,反应方程式为:3Fe+CH4$\frac{\underline{\;高温\;}}{\;}$Fe3C+2H2,
故答案为:3Fe+CH4$\frac{\underline{\;高温\;}}{\;}$Fe3C+2H2;
(5)HCN气体用碳酸钾溶液在填充铁粉的塔内循环吸收,生成亚铁氰化钾,同时还产生两种常见气体为氢气、二氧化碳,该反应的化学方程式为:6HCN+2K2CO3+Fe=K4[Fe(CN)6]+2CO2+H2+2H2O,
故答案为:6HCN+2K2CO3+Fe=K4[Fe(CN)6]+2CO2+H2+2H2O;
(6)用铁粉、稀硫酸、双氧水制备硫酸铁溶液,将硫酸铁溶液滴入食盐水中,产生蓝色沉淀,证明含有K4Fe(CN)6,否则没有,
故答案为:用铁粉、稀硫酸、双氧水制备硫酸铁溶液,将硫酸铁溶液滴入食盐水中,产生蓝色沉淀,证明含有K4Fe(CN)6,否则没有.
点评 本题考查无机物推断、陌生方程式的书写、实验方案设计等,是对学生综合能力的考查,难度较大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
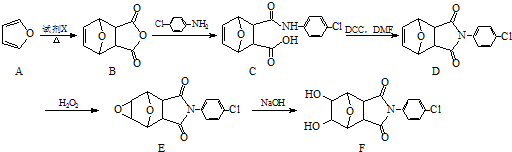
 ;②
;②
 )、羧基和醚键.(填名称)
)、羧基和醚键.(填名称) ;D→E的反应类型是氧化反应.
;D→E的反应类型是氧化反应. 等.
等. )的合成路线流程图(无机试剂可任选)).合成路线流程图示例如下:
)的合成路线流程图(无机试剂可任选)).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
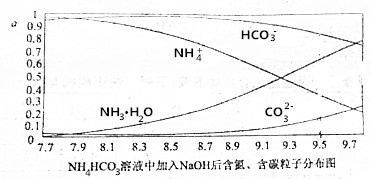
| A. | 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O | |
| B. | 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应 | |
| C. | pH=9.5时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-) | |
| D. | 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 熟石膏与水混合成糊状后会很快凝固,转化为坚硬的生石膏,可用它制作石膏绷带 | |
| C. | 蚕丝、过氧化氢酶、核酸充分水解后均可得到α氨基酸 | |
| D. | 氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水 | B. | 四氯化碳 | C. | 盐酸 | D. | 硫酸镍溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
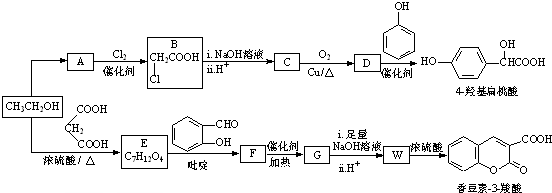
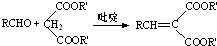 (R,R′,R″表示氢、烷基或芳基)
(R,R′,R″表示氢、烷基或芳基)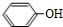 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$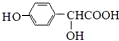 .
.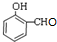 $\stackrel{吡啶}{→}$
$\stackrel{吡啶}{→}$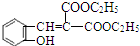 +H2O.
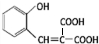
+H2O.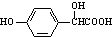 )的同分异构体
)的同分异构体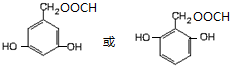 .
. $\stackrel{浓硫酸}{→}$
$\stackrel{浓硫酸}{→}$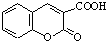 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
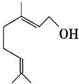 香叶醇是合成玫瑰香油的主要原料,结构可用键线式表示如图,键线式中每个端点和拐点处都代表有一个碳原子,氢原子可根据碳为四价的原则而相应地在碳上补充.下列有关香叶醇的叙述正确的是( )
香叶醇是合成玫瑰香油的主要原料,结构可用键线式表示如图,键线式中每个端点和拐点处都代表有一个碳原子,氢原子可根据碳为四价的原则而相应地在碳上补充.下列有关香叶醇的叙述正确的是( )| A. | 香叶醇的分子式为C10H18O | B. | 不能使溴的四氯化碳溶液褪色 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能发生加成反应不能发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com