
| A. | 水 | B. | 四氯化碳 | C. | 盐酸 | D. | 硫酸镍溶液 |
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 能够节约原料和能源 | B. | 能提高产品的产量 | ||
| C. | 能够提高化学反应速率 | D. | 能够提高经济效益 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
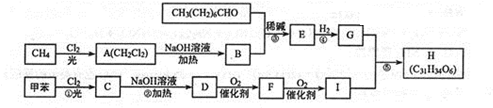
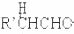 $\stackrel{稀碱}{→}$
$\stackrel{稀碱}{→}$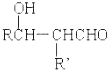
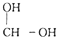 -OH$\stackrel{-H_{2}O}{→}$RCHO
-OH$\stackrel{-H_{2}O}{→}$RCHO .
. .
.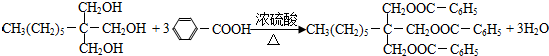 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +CO$→_{△}^{AlCl_{3},HCl}$
+CO$→_{△}^{AlCl_{3},HCl}$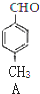 $→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$
$→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$ $→_{浓硫酸△}^{CH_{3}OH}$E
$→_{浓硫酸△}^{CH_{3}OH}$E .
.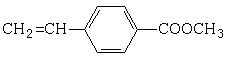 B.
B.
 D
D
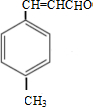
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
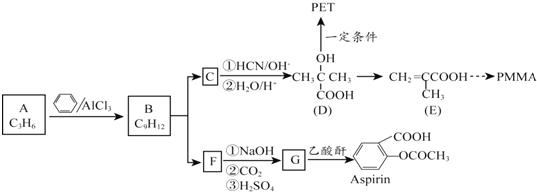
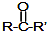 $→_{②H_{2}O/H+}^{①HCN/OH-}$
$→_{②H_{2}O/H+}^{①HCN/OH-}$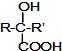
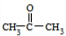 .
.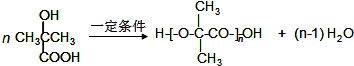 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
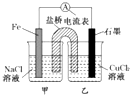
| A. | 原电池的总反应为 Fe+Cu2+=Fe2++Cu | |
| B. | 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2 mol电子 | |
| C. | 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑ | |
| D. | 盐桥中是KNO3溶液,则盐桥中NO3-移向乙烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
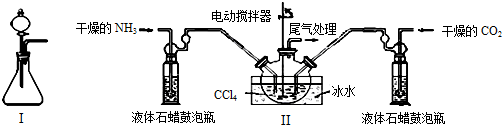
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置. | 溶液变浑浊,则证明固体中含有(NH4)2CO3. |
| 步骤3:取步骤2的上层清液于试管中加入少量的Ba(OH)2溶液. | 溶液不变浑浊,则证明固体中不含有NH4HCO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电负性较大的元素在化合物中只能形成负价,不能形成正价 | |
| B. | 若元素X的第一电离能比元素Y的第一电离能小,则X的金属活动性不一定强于Y | |
| C. | H元素与F元素的电负性差值达1.9,所以HF属于离子化合物 | |
| D. | 某元素原子外围电子排布式为3d64s2,则此元素可能易显+2和+3价,且+3价稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com