
【题目】下表是![]() 时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是![]()
化学式 | AgCl |
|
| HClO |
|
Ksp或Ka |
|
|
|
|
|
A.相同浓度![]() 和NaClO的混合液中,各离子浓度的大小关系是
和NaClO的混合液中,各离子浓度的大小关系是![]()
B.向![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() :
:![]() :9,此时溶液
:9,此时溶液![]()
C.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
D.向浓度均为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀.
先形成沉淀.
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】某研究小组拟以对苯二酚为原料合成染料G。合成路线如下:
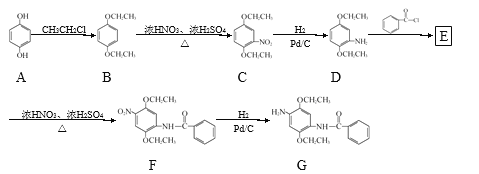
![]()
![]() 中的含氧官能团名称为________、________。
中的含氧官能团名称为________、________。
![]() 的反应类型为________。
的反应类型为________。
![]() 的分子式为
的分子式为![]() ,写出E的结构简式:________。
,写出E的结构简式:________。
![]() 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___。
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___。
![]() 含有苯环,且分子中有一个手性碳原子,能与
含有苯环,且分子中有一个手性碳原子,能与![]() 溶液发生显色反应;
溶液发生显色反应;![]() 能发生水解反应,水解产物均有4种不同环境的氢且水解产物之一是
能发生水解反应,水解产物均有4种不同环境的氢且水解产物之一是![]() 氨基酸。
氨基酸。
![]() 已知:
已知:![]() 苯胺
苯胺![]()
![]()
![]() 易被氧化;
易被氧化;![]()
![]()
![]()
![]()
![]() ,写出以
,写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图________(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图________(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
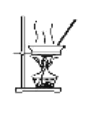
【题目】下列有关实验叙述正确的是( )
A.将过量硼酸(H3BO3)溶液加入Na2CO3溶液中,无明显现象,但发生了反应
B.根据密度的不同,用加水后再分液的方法可将苯和四氯化碳分离
C.用如图装置蒸干溶液,可制得无水MnCl2固体
D.冷却Cu与浓硫酸反应后的液体,向其中加入水以观察CuSO4溶液的颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hg 是水体污染的重金属元素之一。水溶液中的二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中涉及的物质或粒子只有Hg(OH)2 为难溶物,粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-1gc(Cl-)]:

下列说法中错误的是
A. Hg(NO3)2固体溶于水通常会出现浑浊
B. 海水Cl-的浓度大于0.1mol/L,则其中汞元素的主要存在形态是Hg(OH)2
C. 少量Hg(NO3)2溶于0.001moL/L盐酸后得到澄清透明溶液
D. 已知Ksp(HgS)=1.6×10-52,当c(S2-)=1×10-5mo/L 时,c(Hg2+)=1.6×10-47mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知表中是某些有机物的模型图,根据要求回答下列问题:
有机物 | 甲 | 乙 | 丙 |
模型 |
|
|
|
(1)甲的分子式是___________________,其一氯代物有___________________种。
(2)写出乙与![]() 的
的![]() 溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
(3)丙的摩尔质量为![]() ,则用苯制备该物质时的催化剂是___________________。
,则用苯制备该物质时的催化剂是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H8的有机物,能使溴的CCl4溶液褪色,也能使酸性KMnO4溶液褪色,并且它的分子中碳上的一个氢原子被氯取代后的一氯代物只有一种,该有机物可能是( )
A. B.
B.![]()
C. (立方烷)D.
(立方烷)D.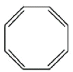 (环辛四烯)
(环辛四烯)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.100mL、![]() 的HA和HB分别与足量的锌充分反应,HA放出的氢气多,说明HA的酸性比HB弱
的HA和HB分别与足量的锌充分反应,HA放出的氢气多,说明HA的酸性比HB弱
B.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
C.在![]() 溶液中由于铵根的水解促进了水的电离,所以水的电离程度增大
溶液中由于铵根的水解促进了水的电离,所以水的电离程度增大
D.在一密闭容器中发生![]() 反应,增大压强,平衡会正向移动,
反应,增大压强,平衡会正向移动,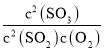 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液。整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是
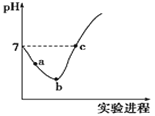
A.实验过程中用pH试纸测定溶液的pH
B.a~b段,溶液中![]() 减小
减小
C.b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-)
D.c点对应溶液中:c(Na+)=c(Cl-)+c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜改革国外的纯碱生产工艺,创造了侯德榜制碱法又叫联碱法,该法是将合成氨工厂生产的NH3及副产品CO2,再与饱和食盐水反应.
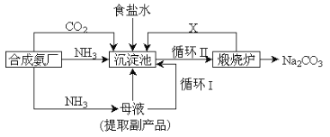
(1)该法与氨碱法比大大提高了原料利用率,主要表现在_______。
(2)碳酸氢钠分解产生的二氧化碳可循环使用,但必须要补充,补充的主要原因是_________,但实际生产中补充量超过理论上反应耗用量,可能的原因是______。
(3)氨碱法需补充的二氧化碳一定来自_________。那么联合制碱需补充的二氧化碳可能来自__________。
(4)侯德榜法在滤去碳酸氢钠的母液中通氨气并加入细小食盐颗粒,冷却析出副产品,通氨气的作用____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com