
若NA为阿伏加德罗常数的值。参阅表中数据,下列判断在标准状况下正确的是
℃ | NO2 | HF |
熔点 | —11.2 | —83.6 |
沸点 | 21.0 | 19.52 |
A.20. 0 gHF中含σ键数目为1.0NA
B.将22.4LNH3溶于1L水中,溶液含有OH-数目为0.1NA
C.6.72 LNO2与水反应后,转移的电子数为0.2NA
D.H2S和SO2各0.l mol反应后,体系中的S原子数目小于0.2NA
A
【解析】
试题分析:A、20.0gHF的物质的量是20.0g/20g/mol=1mol,HF中只含1个σ键,则σ键的数目是NA,正确;B、标准状况, 22.4L的氨气的物质的量是1mol, 而氨气溶于水,与水反应生成一水合氨是可逆反应,一水合氨的电离也是可逆反应,平衡常数未知,所以生成的氢氧根离子的数目无法计算,错误;C、标准状况下二氧化氮为液体,物质的量是不是0.3mol,则转移电子数不是0.2NA,错误;D、H2S和SO2各0.l mol反应后,根据元素守恒,则体系中S原子的物质的量是0.2mol,S原子数是0. 2NA,错误,答案选A。
考点:考查阿伏伽德罗常数与微粒数的关系


科目:高中化学 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:选择题
根据下图,下列判断中正确的是

A.烧杯a中的溶液pH升高
B.烧杯a中发生的反应为2H2O+2e-=H2↑+2OH-
C.烧杯b中发生还原反应
D.烧杯b中发生的反应为2Cl--2e-=Cl2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(文)试卷(解析版) 题型:选择题
下列有关蛋白质的叙述中,不正确的是:
A.蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水也不溶解
B.人工合成的具有生命活性的蛋白质—结晶牛胰岛素,是1965年我国科学家最先合成的
C.重金属盐能使蛋白质变性,所以误食重金属盐会中毒
D.浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:选择题
下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是
A.浓硫酸可用来干燥某些气体(不挥发性)
B.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性)
C.在加热条件下铜与浓硫酸反应(氧化性、酸性)
D.浓硫酸在白纸上书写的字迹变黑(吸水性)
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:选择题
氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不包含氧化还原反应的是
A.常温时浓硫酸能使铝、铁钝化 B.点制豆腐
C.食物腐败 D.燃放鞭炮
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:填空题
(14分)( I )在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g) 2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:
2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0,熵变△S_____0 ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。

(2)该反应的v-t图像如图2中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图2中右图所示。以下说法正确的是 。
① a1>a2 ②b1<b2 ③ t1>t2 ④ 右图中阴影部分面积更大 ⑤两图中阴影部分面积相等
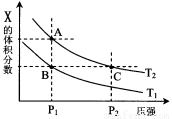
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图所示。下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g) pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左,向右,不)。
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol.。
(3)当压强为1×106 Pa时,此反应的平衡常数表达式: 。
(4)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.增大压强任何反应的反应速率都一定增大
B.已知H2CO3的电离常数分别为Ka1=4.3×10-7、Ka2=5.61×10-11,苯酚的电离常数Ka=1.1×10-10。苯酚钠溶液中通入少量CO2时的化学方程式为:
C.pH=2的盐酸和pH=4的硫酸溶液等体积混合后溶液的pH=3
D.在滴有酚酞的氢氧化钠溶液中逐滴滴入盐酸至红色恰好消失,此时溶液的pH=7
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津南开区高三上学期第三次月考理综化学试卷(解析版) 题型:填空题
(18分)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用研究。
(1)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是___ _(填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
②适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2 mol CO2和6 mol H2,
一定条件下发生反应:CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H=-49.0 kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
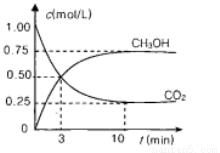
的转化率= ;能使平衡体系中n(CH3OH)增大的措施有 。
(2)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
己知:①CH4(g)+2O2(g)=CO2(g)+2H2O( l ) △H=-890.3kJ/mol
②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
(3)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式 。当电子转移的物质的量为________时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
溶解度(s)/g | 溶度积(Ksp) | ||
Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
吸收CO2最合适的试剂是__ __(填“Ca(OH)2”或“Ba(OH)2”)溶液。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
下表数据是对应物质的熔点,下列说法错误的是
编号 | ① | ② | ③ | ④ |
物质 | AlF3 | AlCl3 | BCl3 | NCl3 |
熔点/℃ | 1291 | 160 | -107 | -40 |
A.BCl3、NCl3分子中各原子最外层都满足8电子稳定结构
B.因为键长B-F< B-Cl,故BF3的熔点高于BCl3
C.AlF3、AlCl3都是强电解质,但晶体类型不同
D.BCl3为平面正三角形分子,故它是由极性键构成的非极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com