
【题目】

①配制一定物质的量浓度的硬脂酸的苯溶液;
②测定从胶头滴管滴出的每滴液体的体积;
③测定在水槽水面上形成硬脂酸单分子膜所需硬脂酸苯溶液的滴数,(如上图所示)用胶头滴管
吸取硬脂酸的苯溶液,垂直往水面中滴一滴,待苯在水面上全部挥发,硬脂酸分子在水面扩散至看不到油珠时,再滴第二滴,如此逐滴滴下,直到整个水面形成单个分子厚的硬脂酸分子所形成的膜为止(该单分子膜分子是紧密排列的,此时如再滴入硬脂酸溶液,该溶液在水面上不再扩散);
④测量水槽中水的表面积;
⑤计算求得阿伏加德罗常数。
(1)在第一步实验中,称取一定质量的硬脂酸后,配制溶液所需的玻璃仪器主要有 、 、 。
(2)第二步实验,测定从胶头滴管滴出的每滴液体的体积,常用方法是
(3)若硬脂酸苯溶液的浓度为c molL-1,测得胶头滴管滴出的每滴溶液的体积为V mL,水面上形成硬脂酸单分子膜时滴下的硬脂酸溶液的滴数为d,水槽中水的表面积为S cm2,每个硬脂酸分子的截面积为A cm2。求阿伏加德罗常数NA(用c、V、d、S、A的代数式表示): 。
(4)若水中含有少量氢氧化钠溶液,则会对测定的NA值有何影响? (选填“偏大”、“偏小”或“无影响”)。
【答案】(1)容量瓶、烧杯、胶头滴管、玻璃棒;
(2)往小量筒中滴入1 mL溶液,然后记下总滴数,从而计算出1滴溶液的体积;
(3)NA=1000S/AcdV;
(4)偏小。
【解析】试题分析:(1)配制一定物质的量浓度的实验,需要的步骤是:称量→溶解→冷却→转移→洗涤→振荡→定容→摇匀,称取一定质量的硬脂酸钠后,需要的仪器有烧杯、玻璃棒、容量瓶、胶头滴管;(2)就像初中学过,一张纸的质量不容易测,但可以测出50张纸的质量,然后除以总张数,就是一张纸的质量,因此往小量筒中滴入1 mL溶液,然后记下总滴数,从而计算出1滴溶液的体积;(3)水面上形成硬脂酸单分子膜需要的硬脂酸苯溶液的体积为VdmL,需要硬脂酸的物质的量为Vd×10-3×cmol,水槽中水的表面积等于所有硬脂酸分子的截面积,即Vd×10-3×c×NA×A=S,则NA=1000S/AcdV;(4)含有少量的NaOH,硬脂酸与NaOH发生反应,需要的硬脂酸的体积增大,根据上述阿伏加德罗常数的公式,NA将会偏小。


科目:高中化学 来源: 题型:
【题目】根据下图,下列判断中正确的是
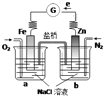
A.向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成
B.烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低
C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
D.烧杯b中发生反应为Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g) ![]() 2C(g)+D(g);H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是

A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减少
C.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
D.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C 的体积分数的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有a mol FeBr2的溶液中,通入 x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2===Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
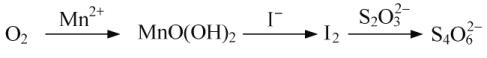
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式;_____________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(用mg·L1表示),写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g ) △H=-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H=-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
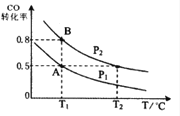
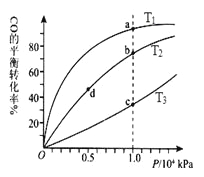
(1)该反应的化学平衡常数表达式为_________ 。
(2)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= ___ L。
(3)关于反应CO(g)+2H2(g)![]() CH3OH(g)在化学平衡状态时的描述正确的是(填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是(填字母)。
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2) D.容器中混合气体的平均相对分子质量保持不变
(4)CO(g)+2H2(g)![]() CH3OH(g),按照相同的物质的量 投料,测得CO在 不同温度下的平衡转化率与压强的关系如上图所示。下列说法正确的是( ) 。
CH3OH(g),按照相同的物质的量 投料,测得CO在 不同温度下的平衡转化率与压强的关系如上图所示。下列说法正确的是( ) 。
A.温度:T1 < T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) = K(c) ; K(b) >K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(5)某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的开关时,观察到电流计的指针发生了偏转。
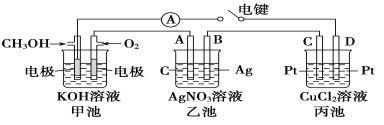
请回答下列问题:
(a)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为____mL(标准状况),丙池中______(填“C”或“D”)极析出_____g铜。
(b)若丙池中电极不变,将其中溶液换成NaCl溶液,开关闭合一段时间后,甲池中溶液的pH将____(填“增大”、“减小”或“不变”,下同);丙池中溶液的pH将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料] (NH4)2SO4在260℃和400℃时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
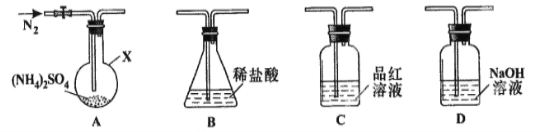
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2,品红溶液不褪色。已知中和装置B中剩余盐酸需0.2000mol/L NaOH溶液25.00 mL,且中和后的溶液中无SO42-。
(1)仪器X的名称是________________;
(2)装置B内溶液吸收气体的物质的量是__________mol;
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
(3)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是 ;
(4)装置B内溶液吸收的气体是 ;
(5)(NH4)2SO4在400℃分解的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素性质或原子结构的递变,叙述不正确的是( )
A. Na、Mg、Al原子最外层电子数依次增多
B. P、S、Cl元素最高正化合价依次增大
C. N、O、F得电子能力依次减弱
D. LiOH、NaOH、KOH的碱性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种变化中,不属于化学变化的是
A.向鸡蛋白溶液中滴入饱和硫酸铵溶液,析出白色沉淀
B.加热胆矾得到白色的无水硫酸铜粉末
C.向沸水中滴入饱和氯化铁溶液,制取氢氧化铁胶体
D.向鸡蛋白溶液中滴入硝酸铅溶液,析出白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com