
【题目】含有a mol FeBr2的溶液中,通入 x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2===Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的一组是
A.Mg2+、Al3+、Cl-、OH-
B.Na+、Ba2+、OH-、SO42—
C.K+、Na+、NO3—、HCO3—
D.K+、NH4+、CO32—、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从结构的角度可以帮助我们更好的理解有机物的化学性质。
(1) 乙炔是一种重要的化工原料,将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为____________。乙炔与氢氰酸反应可得丙烯腈H2C=CH-C≡N。丙烯腈分子中碳原子轨道杂化类型是____________。[Cu(NH3)2]Cl的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式______________________。
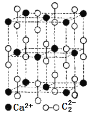
(2)实验室制乙炔使用的电石主要含有碳化钙,写出碳化钙的电子式______________, CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形![]() 的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的
的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的![]() 数目为____________。已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为____________cm3
数目为____________。已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为____________cm3
(3) 甲醇催化氧化可得到甲醛,甲醛分子中的键角大约为____________,甲醇的沸点比甲醛的高,其主要原因是_____________________。
(4)已知苯酚具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子为![]() 判断相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是___。
判断相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组依据反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
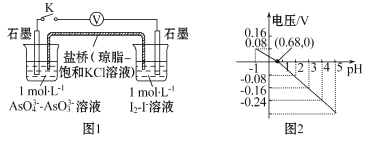
A.调节pH可以改变反应的方向
B.pH=0.68时,反应处于平衡状态
C.pH=5时, 负极电极反应式为2I--2e -= I2
D.pH>0.68时,氧化性I2>AsO43-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知下列反应:SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ==SO42 (aq)+Cl (aq) ΔH2 CaSO4(s) ==Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。(用ΔH1 ΔH2ΔH3表示)
(2)工业上用H2和Cl2反应制HCl,各键能数据为:H﹣H:436kJ/mol,Cl﹣Cl:243kJ/mol,H﹣Cl:431kJ/mol.该反应的热化学方程式是 。
(3)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=﹣72kJ·mol﹣1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ·mol﹣1
氢气与氧气反应生成水蒸气的热化学方程式为 。
现有1mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应.若x=0.2时,反应①放出的能量为 kJ;若x= 时,反应①与②放出(或吸收)的总能量为0。
(4) 一定条件,在水溶液中1 mol Cl-和1 mol ClOx-(x=1,2,3,4)的能量(KJ)相对大小如图所示
。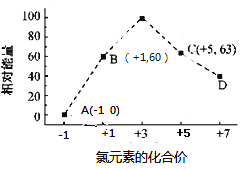
①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,22.4L CHCl3含氯原子数为3NA
B.100mL 1 mol·L-1醋酸溶液中的氢原子数为0.4NA
C.常温常压下,11.2g乙烯中共用电子对数为2.4NA
D.6.4 g CaC2晶体中所含的离子总数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

①配制一定物质的量浓度的硬脂酸的苯溶液;
②测定从胶头滴管滴出的每滴液体的体积;
③测定在水槽水面上形成硬脂酸单分子膜所需硬脂酸苯溶液的滴数,(如上图所示)用胶头滴管
吸取硬脂酸的苯溶液,垂直往水面中滴一滴,待苯在水面上全部挥发,硬脂酸分子在水面扩散至看不到油珠时,再滴第二滴,如此逐滴滴下,直到整个水面形成单个分子厚的硬脂酸分子所形成的膜为止(该单分子膜分子是紧密排列的,此时如再滴入硬脂酸溶液,该溶液在水面上不再扩散);
④测量水槽中水的表面积;
⑤计算求得阿伏加德罗常数。
(1)在第一步实验中,称取一定质量的硬脂酸后,配制溶液所需的玻璃仪器主要有 、 、 。
(2)第二步实验,测定从胶头滴管滴出的每滴液体的体积,常用方法是
(3)若硬脂酸苯溶液的浓度为c molL-1,测得胶头滴管滴出的每滴溶液的体积为V mL,水面上形成硬脂酸单分子膜时滴下的硬脂酸溶液的滴数为d,水槽中水的表面积为S cm2,每个硬脂酸分子的截面积为A cm2。求阿伏加德罗常数NA(用c、V、d、S、A的代数式表示): 。
(4)若水中含有少量氢氧化钠溶液,则会对测定的NA值有何影响? (选填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,饱和NaClO溶液的pH约为11。某消毒液的主要成分为NaClO,洁厕灵主要成分为HCl。下列解释相关事实的离子方程式中不合理的是
A.该消毒液加白醋生成HClO,可增强消毒能力:H++ClO-=HClO
B.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=ClO-+Cl-+H2O
C.常温下,该消毒液的pH≈11,是因为:ClO-+H2O![]() HClO+OH-
HClO+OH-
D.该消毒液与洁厕灵混用会引起中毒:2H++Cl-+ClO-=Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的。请回答:
(1)A原子的核外电子排布的轨道表示式________,B原子的核外电子排布式______________________,C原子的价电子排布式________。
(2)A、B、C的气态氢化物的化学式分别是________,其中最不稳定的是________。
(3)它们的最高价氧化物的水化物中,酸性最强的是________。
(4)AC4的化学式________,电子式________,结构式________,中心原子A的杂化方式________杂化,是________(填“极性”或“非极性”)分子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com