
【题目】从结构的角度可以帮助我们更好的理解有机物的化学性质。
(1) 乙炔是一种重要的化工原料,将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为____________。乙炔与氢氰酸反应可得丙烯腈H2C=CH-C≡N。丙烯腈分子中碳原子轨道杂化类型是____________。[Cu(NH3)2]Cl的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式______________________。
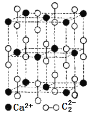
(2)实验室制乙炔使用的电石主要含有碳化钙,写出碳化钙的电子式______________, CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形![]() 的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的
的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的![]() 数目为____________。已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为____________cm3
数目为____________。已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为____________cm3
(3) 甲醇催化氧化可得到甲醛,甲醛分子中的键角大约为____________,甲醇的沸点比甲醛的高,其主要原因是_____________________。
(4)已知苯酚具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子为![]() 判断相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是___。
判断相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是___。
【答案】(1)[Ar]3d10 4[Cu(NH3)2]+ +O2+8NH3H2O=4[Cu(NH3)4]2+ +6H2O+4OH- 或
4[Cu(NH3)2]+ +O2+8NH3+2H2O=4[Cu(NH3)4]2+ +4OH- sp2sp
(2) ![]() 4 1.9×10-22g/mL
4 1.9×10-22g/mL
(3)120度 乙醇有分子间氢键,乙醛没有分子间氢键
(4) < 水杨酸中-OH的氢原子形成分子内氢键,不易电离
【解析】
试题分析:(1)铜的原子序数是29,则根据核外电子排布规律可知,Cu+基态核外电子排布式为[Ar]3d10;丙烯腈分子中碳原子只形成碳碳双键和碳碳三键,则碳原子的轨道杂化类型是sp2、sp;[Cu(NH3)2]Cl的氨水溶液在空气中放置迅速由无色变为深蓝色,说明亚铜离子被氧化为铁离子,则该过程的离子方程式4[Cu(NH3)2]+ +O2+8NH3H2O=4[Cu(NH3)4]2+ +6H2O+4OH- 或4[Cu(NH3)2]+ +O2+8NH3+2H2O=4[Cu(NH3)4]2+ +4OH-。
(2)碳化钙是离子化合物,其电子式去![]() ;Ca2+位于晶胞的棱上,由于晶胞沿一个方向拉长,1个Ca2+周围距离最近的C22-有4个,而不是6个;根据晶胞结构可知可被含有4个钙离子,则晶胞的体积是
;Ca2+位于晶胞的棱上,由于晶胞沿一个方向拉长,1个Ca2+周围距离最近的C22-有4个,而不是6个;根据晶胞结构可知可被含有4个钙离子,则晶胞的体积是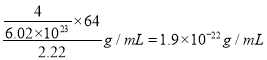 ;
;
(3)甲醛分子是平面三角形结构,其中的键角大约为102°;甲醇有分子间氢键,甲醛没有分子间氢键,因此甲醇的沸点比甲醛的高;
(4)水杨酸第一级电离形成的离子为![]() ,这说明水杨酸中-OH的氢原子形成分子内氢键,不易电离,因此相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)。
,这说明水杨酸中-OH的氢原子形成分子内氢键,不易电离,因此相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患。检测某工厂废液中含有大量Mg2+、Al3+、Cu2+、Ag+。试分析回答下列问题:
(1)该废液中可能大量存在的一种阴离子是 (填序号);
A.SO![]() B.NO
B.NO![]() C.Cl
C.Cl![]() D.CO
D.CO![]()
(2)为检测废液中铝元素的含量需将其从废水样品中分离出来,所用的试剂是 ;其中镁元素发生变化的离子方程式是 ;
(3)为了回收废液中的金属银,某同学设计了如下方案:
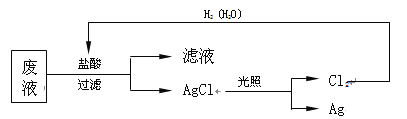
若该方案获得Ag 108 g,为保证不污染环境和Cl2的循环利用,理论上应提供标准状况下的H2的体积是 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图,下列判断中正确的是
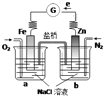
A.向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成
B.烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低
C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
D.烧杯b中发生反应为Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A.含金属元素的离子不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.最高价含氧酸一定具有强氧化性
D.金属阳离子被还原一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图:![]() 。已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )
。已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )
A.分子中 N、O 间形成的共价键是极性键
B.图中加“*”N原子的杂化方式为sp3
C.该物质既有氧化性又有还原性
D.15.2g 该物质含有 6.02×1022个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使甲醚在制药、燃料、农药等化学工业中有许多独特的用途。
(1)已知:2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
![]()
①平衡时,c(CH3OCH3)等于________ mol·L-1,反应混合物的总能量减少________ kJ。
②若在平衡后的容器中再加入与起始时等量的CH3OH,请在下图中画出CH3OH的浓度的曲线示意图。
Ⅱ甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+ CO(g)![]() CH3OH(g)
CH3OH(g)
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
![]()
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”).
②按下列物质的量发生反应,CO的转化率由大到小的顺序是 (填甲乙丙).

(3)已知在常温常压下:化学反应①②③④的平衡常数分别为K1,K2,K3,K4
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) K1
②2CO(g)+O2(g)=2CO2(g)K2
③H2O(g)=H2O(l)K3
④CH3OH(l)+O2(g)=CO(g)+2H2O(l)K4
则K4= (用含有K1,K2,K3的代数式表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g) ![]() 2C(g)+D(g);H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是

A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减少
C.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
D.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C 的体积分数的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有a mol FeBr2的溶液中,通入 x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2===Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素性质或原子结构的递变,叙述不正确的是( )
A. Na、Mg、Al原子最外层电子数依次增多
B. P、S、Cl元素最高正化合价依次增大
C. N、O、F得电子能力依次减弱
D. LiOH、NaOH、KOH的碱性逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com