
【题目】科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图:![]() 。已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )
。已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )
A.分子中 N、O 间形成的共价键是极性键
B.图中加“*”N原子的杂化方式为sp3
C.该物质既有氧化性又有还原性
D.15.2g 该物质含有 6.02×1022个原子
科目:高中化学 来源: 题型:
【题目】均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6.A和C分子中的原子个数比为1:1,B和D分子中的原子个数比为1:2.D可作为火箭推进剂的燃料.请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为 (用元素符号回答).
(2)A与HF相比,其熔、沸点较低,原因是 .
(3)B分子的空间构型为 形,该分子属于 分子.(填“极性”或“非极性”)
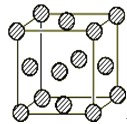
(4)C为一种绿色氧化剂,有广泛应用.请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式: ,该反应中反应物Cu原子的基 态电子排布式为 .铜晶体中铜原子的堆积方式为面心立方堆积,如图是铜晶体一个晶胞的示意图,则晶胞中含 个铜原子.
(5)D分子中心原子的杂化方式是 ,由该原子组成的单质分子中包含 个π键,与该单质分子互为等电子体的常见分子的分子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24L苯含有的分子数为0.1NA
B.标准状况下,11.2L乙烷中含有共价键的数目为3NA
C.常温下,1mol羟基中含有的电子数为9NA
D.1mol冰醋酸和1mol乙醇在浓硫酸加热下充分反应生成H2O个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______,晶体中原子间通过_____作用形成面心立方密堆积,其中M原子的配位数为______。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
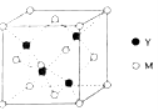
①该化合物的化学式为_______,已知晶胞参数a=0.542 nm,此晶体的密度为_______g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从结构的角度可以帮助我们更好的理解有机物的化学性质。
(1) 乙炔是一种重要的化工原料,将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为____________。乙炔与氢氰酸反应可得丙烯腈H2C=CH-C≡N。丙烯腈分子中碳原子轨道杂化类型是____________。[Cu(NH3)2]Cl的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式______________________。
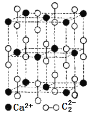
(2)实验室制乙炔使用的电石主要含有碳化钙,写出碳化钙的电子式______________, CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形![]() 的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的
的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的![]() 数目为____________。已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为____________cm3
数目为____________。已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为____________cm3
(3) 甲醇催化氧化可得到甲醛,甲醛分子中的键角大约为____________,甲醇的沸点比甲醛的高,其主要原因是_____________________。
(4)已知苯酚具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子为![]() 判断相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是___。
判断相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4倍;C与E同主族。
请回答下列问题:
(1)X的化学式为_____ _,元素D与E形成的酸式盐的电子式:___ __。
(2)元素的非金属性C、E的强弱比较,下列各项中,能说明这一结论的事实有_____(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。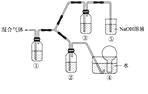
已知(ⅰ) 浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ) NaOH溶液与BC2反应的化学方程式为:2NaOH+2BC2═NaBC2+NaBC3+H2O ;NaOH溶液与BC气体不反应。
a.装置①、②中盛放的药品依次是______、______。
b.能够说明实验已成功的现象是 __ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知下列反应:SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ==SO42 (aq)+Cl (aq) ΔH2 CaSO4(s) ==Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。(用ΔH1 ΔH2ΔH3表示)
(2)工业上用H2和Cl2反应制HCl,各键能数据为:H﹣H:436kJ/mol,Cl﹣Cl:243kJ/mol,H﹣Cl:431kJ/mol.该反应的热化学方程式是 。
(3)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=﹣72kJ·mol﹣1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ·mol﹣1
氢气与氧气反应生成水蒸气的热化学方程式为 。
现有1mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应.若x=0.2时,反应①放出的能量为 kJ;若x= 时,反应①与②放出(或吸收)的总能量为0。
(4) 一定条件,在水溶液中1 mol Cl-和1 mol ClOx-(x=1,2,3,4)的能量(KJ)相对大小如图所示
。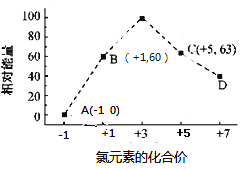
①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,H2O2在水溶液中发生分解反应:2H2O2 ![]() 2H2O + O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O + O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
![]()
(1)H2O2的分解反应__氧化还原反应(填“是”或“不是”)。要加快该反应的速率,可采取的方法有 。
(2)该分解反应0─20min的平均反应速率v(H2O2)为 mol·L-1 min-1。
(3)如果反应所用的H2O2溶液为100mL,则共产生O2 g。
A.0.08 B.0.16 C.1.2 D.2.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com