
分析 (1)依据反应:Cu+2FeCl3═CuCl2+2FeCl2、Fe+CuCl2=FeCl2+Cu判断溶液中剩余的金属离子、固体物质的成分;
(2)9.6gCu的物质的量为:$\frac{9.6g}{64g/mol}$=0.15mol,依据Cu+2FeCl3═CuCl2+2FeCl2计算即可;
(3)利用物质的量守恒以及电子得失守恒计算即可.
解答 解:(1)加入Fe粉前,溶液中有Cu2+,Fe2+,Cl-,可能还有Fe3+,8.4gFe为0.15mol,9.6gCu为0.15mol,若无Fe3+,那么Fe恰好把9.6gCu全部置换,现在只有4.8g不容物,所以不可能为Fe只能是Cu;
故答案为:Cu2+;Fe;Cu;
(2)9.6gCu的物质的量为:$\frac{9.6g}{64g/mol}$=0.15mol,1molCu失去电子数为2,故失去电子数为0.3mol,1molFe3+变为Fe2+,得到电子数为1mol,依据氧化还原反应得失电子守恒,故有0.3mol的Fe2+生成,
故答案为:0.3;
(3)反应顺序是Fe先和过量的Fe3+反应,再置换部分Cu2+,所以存在Cl-,Fe2+,Cu2+;溶液中剩余的Cu元素为9.6-4.8=4.8g,0.075mol,[Cu2+]=$\frac{0.075}{0.12}$=0.625mol/L 综合来看,溶液中是4.8gCu和8.4gFe恰好完全还原了Fe3+,Cu失电子为0.15mol,Fe失电子0.3mol,合计0.45mol,所以原有Fe3+0.45mol,最后所有的Fe元素都变成Fe2+,故[Fe2+]=$\frac{0.15+0.45}{0.12}$mol/=5.0mol/L,
故答案为:0.625mol/L;5mol/L.
点评 本题主要考查的是铜以及铁之间的转化关系、有关物质量的计算,属于中等题,锻炼了同学们分析问题、解决问题的能力.


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 | |
| B. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )的混和物溶于100mL 1mol/L NaOH溶液中,然后用0.5mol/L H2SO4溶液滴定过量的NaOH,消耗硫酸溶液30mL.另取m g上述混和物溶于过量甲醇中,加入少量浓硫酸,加热使完全反应,分离、精制,得到酯的混和物,其质量比 m g增加15.8%,则m的数值为多少?
)的混和物溶于100mL 1mol/L NaOH溶液中,然后用0.5mol/L H2SO4溶液滴定过量的NaOH,消耗硫酸溶液30mL.另取m g上述混和物溶于过量甲醇中,加入少量浓硫酸,加热使完全反应,分离、精制,得到酯的混和物,其质量比 m g增加15.8%,则m的数值为多少?查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Q1+Q2<Q3,则反应为放热反应 | B. | 若Q1+Q2<2Q3,则反应为放热反应 | ||
| C. | 若E1+E2>E3,则反应为放热反应 | D. | 若E1+E2>E3,则反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑤ | B. | 只有⑤⑦ | C. | 只有①③⑦ | D. | 只有①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Br$→_{水}^{NaOH}$ CH3CH2OH$→_{170℃}^{浓硫酸}$ CH2=CH2$\stackrel{Br_{2}}{→}$ CH2BrCH2Br | |
| B. | CH3CH2Br $\stackrel{HBr}{→}$ CH2BrCH2Br | |
| C. | CH3CH2Br $→_{水}^{NaOH}$ CH2=CH2 CH2BrCH3$\stackrel{HBr_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br $→_{醇}^{NaOH}$ CH2=CH2$\stackrel{Br_{2}}{→}$ CH2BrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的结构示意图: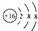 | |
| B. | HCl的电子式: | |
| C. | 乙酸的结构式:C2H4O2 | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com