
分析 (1)二氧化氮和水能反应,一氧化氮和水不反应,根据差量法计算二氧化氮的体积,从而得出一氧化氮的体积;
(2)根据一氧化氮、氧气和水反应方程式进行计算;
(3)由关系式4NO~3O2计算出24 mLNO消耗O2的体积,从而可得出剩余氧气体积;
(4)分情况讨论,剩余气体可能是一氧化氮也可能是氧气,根据一氧化氮和氧气之间的关系式计算.
解答 解:(1)一氧化氮和水不反应,二氧化氮和水能反应,反应方程式为:3NO2+H2O=2HNO3+NO,
设二氧化氮的体积为x,
3NO2+H2O=2HNO3+NO 气体体积减少
3 2
x (48-24)mL=24mL
x=$\frac{24mL×3}{2}$=36mL,
则一氧化氮体积=(48-36)mL=12mL,
NO体积是 12mL,二氧化氮体积是NO2 36 mL,
故答案为:12;36;
(2)剩余气体是一氧化氮,一氧化氮、氧气和水之间的反应式为:4NO+3O2+2H2O=4HNO3,
根据方程式知,一氧化氮和氧气反应的关系是4:3,则有24mL一氧化氮反应时需要18mL氧气,实际上有6mL氧气,所以一氧化氮有剩余,剩余的一氧化氮体积=24mL-$\frac{6mL}{3}$×4=16mL,
故答案为:NO;16;
(3)由4NO~3O2知,24 mLNO消耗O2的体积为:$\frac{3}{4}$×24mL=18mL,所以反应后容器内剩余O2为:24 mL-18 mL=6 mL,
故答案为:O2;6;
(4)剩余4mL无色气体是氧气时,根据4NO+3O2+2H2O=4HNO3知,则通入的氧气体积=$\frac{24mL}{4}$+4mL=22mL,
当剩余4mL无色气体是一氧化氮时,根据方程式知,通入的氧气体积=$\frac{(24-4)mL}{4}$=15mL,
故答案为:15;22.
点评 本题考查了混合物反应的计算,题目难度中等,明确二氧化氮、一氧化氮的性质为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:多选题
| 选项 | A | B | C | D |
| 物质 | 加碘食盐 | 石英砂 | “84”消毒液 | 水玻璃 |
| 主要成分 | KIO3 | SiO2 | Ca(ClO)2 | NaSiO3 |
| 用途 | 预防碘缺乏病 | 作干燥剂 | 作消毒剂 | 木材防火剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
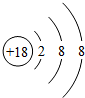 ,由2个原子组成的分子是HCl、由2原子组成具有10电子的阴离子OH-.
,由2个原子组成的分子是HCl、由2原子组成具有10电子的阴离子OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同 | B. | H2SO4溶液消耗的NaOH多 | ||
| C. | HCl溶液消耗的NaOH多 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液不能用带磨口玻璃塞的玻璃瓶盛放 | |
| B. | CO2与水反应生成碳酸,是酸性氧化物;SiO2不能与水反应生成硅酸,不是酸性氧化物 | |
| C. | 除去二氧化硅中少量的碳酸钙杂质应选用水 | |
| D. | 粗硅制备时,发生的反应为C+SiO2═Si+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com