
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| m |
| M |
| 10×103L×650×10-3g/L |
| 65g/mol |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
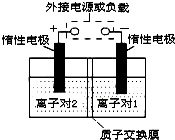 全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.
全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.查看答案和解析>>
科目:高中化学 来源: 题型:
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、B、C、D |
| B、B、A、C、D |
| C、A、B、D、C |
| D、B、A、D、C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4NO3溶液呈酸性的原因:NH4++H2O=NH3?H2O+H+ |
| B、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ |
| C、硫酸氢钠溶液中滴加少量Ba(OH)2溶液的离子方程式:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
D、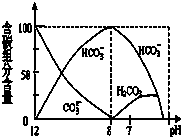 如图是在0.1 mol?L-1Na2CO3溶液中逐滴加入0.1 mol?L-1 HCl,则 pH=7时的离子方程式:H++HCO3-=CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com