
【题目】碳排放是影响气候变化的重要因素之一。最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。下列有关说法中不正确的是( )
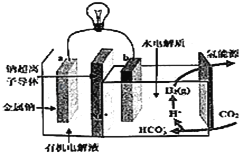
A. 系统工作时,化学能转变成电能
B. 系统工作时,电流由a极沿导线流向b极
C. 系统工作时,b极区可能会析出固体
D. 系统工作时,b极区的电极反应式为2CO2+2H2O+2e﹣=2HCO3﹣+H2
【答案】B
【解析】
由电池工作原理示意图可知反应中Na被氧化为Na+,应为原电池的负极反应,则a电极反应式为Na-e- =Na+ , b正极二氧化碳得电子被还原生成H2,电极反应式为2CO2+2H2O+2e﹣=2HCO3﹣+H2,原电池工作时,阳离子向正极移动 阴离子向负极移动,以此解答该题。
A、该装置是原电池,化学能转变成电能,选项A正确;
B、系统工作时,电流由正极b极沿导线流向负极a极,选项B错误;
C、系统工作时,b正极二氧化碳得电子被还原生成H2,电极反应式为2CO2+2H2O+2e﹣=2HCO3﹣+H2与移动过来的钠离子结合成碳酸氢钠,所以b极区可能会析出碳酸氢钠固体,选项C正确;
D、b正极二氧化碳得电子被还原生成H2,电极反应式为2CO2+2H2O+2e﹣=2HCO3﹣+H2,选项D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】碳及其化合物在能源、材料等方面具有广泛的用途。回答下列问题:
(1)碳酸和草酸(H2C2O4)均为二元弱酸,其电离均为分步电离,二者的电离常数如下表:
H2CO3 | H2C2O4 | |
K1 | 4.2×107 | 5.4×102 |
K2 | 5.6×1011 | 5.4×105 |
①向碳酸钠溶液中滴加少量草酸溶液所发生反应的离子方程式为_____________。
②浓度均为0.1 mol·L1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液,其溶液中H+浓度分别记作c1、c2、c3、c4。则四种溶液中H+浓度由大到小的顺序为________________。
(2)常温时,C和CO的标准燃烧热分别为394.0 kJ·mol1、283.0 kJ·mol1,该条件下C转化为CO的热化学方程式为____________________。
(3)氢气和一氧化碳在一定条件下可合成甲醇,反应如下:2H2(g)+CO(g)![]() CH3OH(g) ΔH=Q kJ·mol1
CH3OH(g) ΔH=Q kJ·mol1
①该反应在不同温度下的化学平衡常数(K)如下表:
温度/℃ | 250 | 300 | 350 |
K/L2·mol2 | 2.041 | 0.270 | 0.012 |
由此可判断Q______(选填“ >”或“<”)0。
②一定温度下,将6 mol H2和2 mol CO充入体积为2 L的密闭容器中,10 min反应达到平衡状态,此时测得c(CO)=0.2 mol·L1,该温度下的平衡常数K=____,0~10 min内反应速率v(CH3OH)=______。
③在两个密闭容器中分别都充入20 mol H2和10 mol CO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如图所示:

若A点对应容器的容积为20 L,则B点对应容器的容积为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间。以下叙述正确的是( )

A. 两烧杯中铜片表面均有气泡产生
B. 甲烧杯中的电流与阳离子流向均为Zn→Cu
C. 两烧杯中溶液的pH均增大
D. 两烧杯在相同时间内转移电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质的变化规律与分子间作用力有关的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、Nal的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知:氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。活泼金属硫化物与酸反应产生H2S气体。
Ⅰ、制备氢化锂:选择下图中的装置制备氢化锂(有些装置可重复使用):

(1)装置的连接顺序(从左至右)为A→___________________________________。
(2)检查好装置的气密性,打开装置A中分液漏斗的活塞后,点燃酒精灯前需进行的实验操作是________。
Ⅱ、制备氢化铝锂
1947年,Schlesinger、Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(3)写出氢化锂与无水三氯化铝反应的化学方程式_________________________。
Ⅲ.测定氢化铝锂产品(不含氢化锂)的纯度
(4)按下图连接好装置后,检查装置气密性的操作是:_____________________。装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是__________________。

(5)在标准状况下,反应前量气管(由碱式滴定管改装而成)读数为V1 mL,反应完毕并冷却之后,量气管读数为V2 mL。该样品的纯度为_________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将_________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:

(1)N、P、As原子的第一电离能由大到小的顺序为_______;As原子的核外电子排布式为______________。
(2)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
(3)Na3AsO4中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是_________。
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为___g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是_____。

(2)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量,已知(见图):则1mol N﹣H键断裂吸收的能量约等于_____kJ。

(3)请将 Zn+2Ag+=2Ag+Zn2+设计成原电池,并画出简易装置图,并注明电极材料以及电解质溶液___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)在容积为5L的密闭容器中,通入5 mol N2和8 mol H2,在一定条件下反应生成NH3,当反应进行到2 min时,测得容器内有4 mol NH3。则:
(1)2 min时,容器内n(N2)== ________ ,c(H2)== ___________ 。
(2)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为 _______ 。
(二)A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C及B与D分别是同主族元素;已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又知A、C两元素原子序数之和是B、D两元素原子序数之和的一半。请回答下列问题:
(1)写出由A、B、C三元素形成的化合物的电子式__________ ,
(2)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 1s电子云界面图是一个球面,表示在这个球面以内,电子出现的概率为![]()
B. 在能层、能级、以及电子云的伸展方向确定时,电子的运动状态才能确定下来
C. 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
D. 原子核外的电子就像行星围绕太阳一样绕着原子核做圆周运动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com