
����Ŀ��(һ)���ݻ�Ϊ5L���ܱ������У�ͨ��5 mol N2��8 mol H2����һ�������·�Ӧ����NH3������Ӧ���е�2 minʱ�������������4 mol NH3����
(1)2 minʱ��������n(N2)== ________ ��c(H2)== ___________ ��
(2)2 minʱ������������������ʵ����뷴Ӧǰ����������������ʵ���֮��Ϊ _______ ��
(��)A��B��C��D���ֶ�����Ԫ�أ����ǵ�ԭ������������������A��C��B��D�ֱ���ͬ����Ԫ�أ���֪B��D��Ԫ�ؼ���γ�DB2��DB3���ֻ����������Է����������16����֪A��C��Ԫ��ԭ������֮����B��D��Ԫ��ԭ������֮�͵�һ�롣��ش��������⣺
(1)д����A��B��C��Ԫ���γɵĻ�����ĵ���ʽ__________ ��
(2)��A��B��C��D����Ԫ���γɵ�����X�������ᷴӦ�ܹ����ɾ��д̼�����ζ�����壬д��X�����ᷴӦ�����ӷ���ʽ________________________��
���𰸡�3 mol 0.4 mol/L 9:13 ![]() HSO3- + H+ ====SO2��+H2O
HSO3- + H+ ====SO2��+H2O
��������
(һ)��1�����ݻ�ѧ����ʽ��ʽ���㣻
��2�����ݷ�Ӧ����ʽ�����ƽ��ʱ�����ʵ������������ʵ���֮�ȣ�
(��) ��֪B��D��Ԫ�ؼ���γ�DB2��DB3���ֻ����������Է����������16�����Ƴ�B�����ԭ������Ϊ16������BΪO������ΪB��Dͬ���壬��D��ԭ����������B������DΪS��B��Dԭ������֮�͵���24��A��C��Ԫ��ԭ������֮����B��D��Ԫ��ԭ������֮�͵�һ�룬����ΪA��Cͬ���壬����AΪH��CΪNa���ݴ˷�����
(һ)��1����Ӧ�ķ���ʽΪ��
N2+3H22NH3��
��ʼ����mol�� 5 8 0
�仯����mol�� 2 6 4
ƽ������mol�� 3 2 4
��2minʱ��������n��N2��=3mol��c��H2��=![]() =0.4mol/L��
=0.4mol/L��
��2���ﵽƽ��ʱ�����ʵ����ʵ���Ϊn��N2��=3mol��n��H2��=2mol��n��NH3��=4mol��������������������ʵ����뷴Ӧǰ���������ʵ����ı�ֵΪ����3+2+4������5+8��=9��13��
(��)��֪B��D��Ԫ�ؼ���γ�DB2��DB3���ֻ����������Է����������16�����Ƴ�B�����ԭ������Ϊ16������BΪO������ΪB��Dͬ���壬��D��ԭ����������B������DΪS��B��Dԭ������֮�͵���24��A��C��Ԫ��ԭ������֮����B��D��Ԫ��ԭ������֮�͵�һ�룬����ΪA��Cͬ���壬����AΪH��CΪNa��
(1)��A��B��C��Ԫ���γɵĻ�����NaOH�ĵ���ʽΪ![]() ��
��
(2)��A��B��C��D����Ԫ���γɵ�����X�������ᷴӦ�ܹ����ɾ��д̼�����ζ������SO2����XΪNaHSO3��X�����ᷴӦ�����ӷ���ʽΪHSO3- + H+ ====SO2��+H2O��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������SO2��Cl2�ڻ���̿�Ĵ�����ȡһ����Ҫ���л��ϳ��Լ������ȣ�SO2Cl2�������õķ�Ӧװ������ͼ��ʾ�����ּг�װ��ʡ�ԣ���
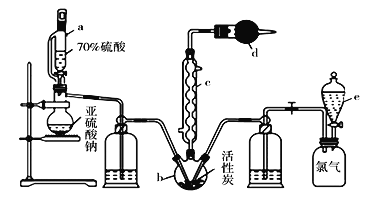
��֪SO2Cl2���۵�Ϊ-54.1�棬�е�Ϊ69.1�棬��ˮ�ܷ������ҵ�ˮ�ⷴӦ������ʪ��������������������ø����Cl2��SO2�ڻ���̿������ȡ�����ȣ�Cl2(g)+SO2(g)![]() SO2Cl2(l)��ʵ��װ����ͼ��ʾ��
SO2Cl2(l)��ʵ��װ����ͼ��ʾ��
��1��������SO2Cl2��SԪ�صĻ��ϼ�Ϊ__________��
��2������c��������_________��c��ͨ����ˮ��������___________
��3��������c��ʹ�ÿ�֪SO2��Cl2�ķ�Ӧ��H____0������<������>����������d ��������____��
��4��������������װ�û�ø����ԭ����Cl2��SO2��װ��e����ʢ�ŵ���ҺΪ______������Һ�����ƣ���
��5��SO2Cl2��ˮ�ܷ������ҵ�ˮ�ⷴӦ���������������SO2Cl2����ˮ�ⷴӦ�Ļ�ѧ����ʽΪ_______��
��6����Ӧ����������b��Ļ�������ķ�����______,
����Ӧ���������������Ϊ1.12L����ת��Ϊ��״����SO2�����������ͨ������õ������Ļ�����5.13g��������ȵIJ���Ϊ___��������λ��Ч���֣���
��7��Ϊ��߱�ʵ���л����ȵIJ��ʣ���ʵ���������Ҫע���������_____(�����)��
����ͨ����ˮ����ͨ�� �ڿ����������ʣ��������˿�
��������ƿ���̣����ʵ����� �ܼ�������ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�ŷ���Ӱ������仯����Ҫ����֮һ���������ѧ�ҿ�����һ����ϵͳ�����ܽ⡱ˮ�еĶ�����̼���Դ����绯ѧ��Ӧ�����ɵ��ܺ��������乤��ԭ����ͼ��ʾ�������й�˵���в���ȷ���ǣ�������
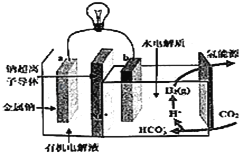
A. ϵͳ����ʱ����ѧ��ת��ɵ���
B. ϵͳ����ʱ��������a���ص�������b��
C. ϵͳ����ʱ��b�������ܻ���������
D. ϵͳ����ʱ��b�����ĵ缫��ӦʽΪ2CO2+2H2O+2e����2HCO3��+H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨ��þ3%��5%����þ�Ͻ���þ�����������������2��ʵ�鷽����˵������ȷ����
����һ��þ���Ͻ��������������������Һ�г�ַ�Ӧ����ˣ��ⶨʣ�����������
������������m g��þ�Ͻ��ĩ������ͼ�ж��Ե��Ȱ��ϣ�ͨ��ʹ�������ա���ù����������ء�
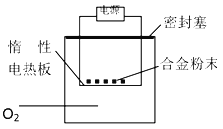
A. ����һ������ȡ5.4 g�Ͻ��ĩ��Ʒ��Ͷ��V mL 2.0 mol/L NaOH��Һ�з�Ӧ����V��100 mL
B. ����һ�вⶨʣ���������ʱ�����˺�δϴ�ӹ�������������þ����������ƫ��
C. ��������������þ������������ʵ���л���ⶨ���պ���������
D. �����������ÿ�������O2����ʵ�飬��ⶨ���ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����к��м��Թ��ۼ������ڸþ���˵���������(����)
A.�����������Ӿ���
B.�������ǵ��ʷ��ӹ��ɵľ���
C.�����Ƿ��Ӿ���
D.���ܾ��нϸߵ��۷е�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��������ͼ��ʾװ��̽�������������ķ�Ӧ���������⣬�ش��������⣺

��1��CH4��Cl2������Ӧ����������������䣻�����չ�ֱ�䣬���ܻ�����______________��
��2��ʵ���пɹ۲쵽��ʵ�������У���Ͳ�ڱڳ�����״Һ�Σ�����ʳ��ˮ������������������_____��_____�ȡ�
��3��ʵ�������ɵ���״Һ�εĻ�ѧʽΪ____________________��
��4����д����������һ�ȼ���Ļ�ѧ����ʽ____________________��
��5���ñ���ʳ��ˮ������ˮ��ԭ����____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ͨ�뺬Fe2+��I-��Br-����Һ����Һ���������ӵ����ʵ����ı仯��ͼ��ʾ����֪b=a+5���߶���ʾһ�ֺ����ᣬ���߶�I�͢���ʾ�������к�����ͬ��Ԫ�ء�����˵���������

A. �߶�I��ʾI-�ı仯���
B. a��ʱ����Cl2�����Ϊ134.4 L
C. ԭ��Һ��n(Fe2+)��n(Br-) =2��3
D. �߶����������ԣ�C12>HIO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ���������G�����ڹ�̹�����������ʴͿ�㡣������һ�ֺϳɸ��л����·�ߣ����ַ�Ӧ������������ʡ�ԣ���
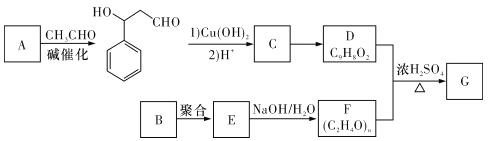
��֪������Ϣ��
I��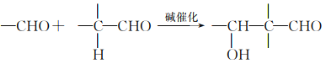 ��
��
��.D��ʹ����KMnO4��Һ��ɫ��
��ͬ��ͬѹ�£�ʵ��ⶨB������ܶ�����̬������ܶ���ͬ��B�к���һ��������һ������
��ش��������⣺
(I)A�Ļ�ѧ������_________��
(2)��C����D�Ĺ����п������ɶ��ָ����������D��Ϊͬ���칹����л���Ľṹ��ʽΪ______��
(3)B�ķ���ʽΪ__________��
(4)��D��F����G�Ļ�ѧ����ʽΪ_____________��
(5)��������������C��ͬ���칹����________�֣������������칹����
�ٸ��л�����һ�ֶ�Ԫ���ᣬ����ʹFeC13��Һ��ɫ��
�ڱ�����������ȡ���������ܷ���������Ӧ��
(6)��D�����²���ɺϳ�K��
![]()
��H�й����ŵ�����Ϊ _______________��
��I�Ľṹ��ʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����![]() ����
����![]()
![]() �ӻ��������ͬһ��ԭ�������������s�����p�����������γɵ�һ��������ͬ���¹��
�ӻ��������ͬһ��ԭ�������������s�����p�����������γɵ�һ��������ͬ���¹��
![]() ͬһ���ڴ����ң�Ԫ�صĵ�һ�����ܡ��縺�Զ���Խ��Խ��
ͬһ���ڴ����ң�Ԫ�صĵ�һ�����ܡ��縺�Զ���Խ��Խ��
![]() �����м���Խ��ʾ����ӵ�е�����Խ��
�����м���Խ��ʾ����ӵ�е�����Խ��
![]() ���е�����ﶼ������λ��
���е�����ﶼ������λ��
![]() ���к����Լ��ķ��Ӷ��Ǽ��Է���
���к����Լ��ķ��Ӷ��Ǽ��Է���
![]() ����״̬���ܵ���Ļ�����һ�������ӻ�����
����״̬���ܵ���Ļ�����һ�������ӻ�����
![]() ���е�ԭ�Ӿ��嶼������
���е�ԭ�Ӿ��嶼������
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com