
【题目】某课外活动小组利用如图所示装置探究甲烷与氯气的反应。根据题意,回答下列问题:

(1)CH4与Cl2发生反应的条件是漫射光照射;若用日光直射,可能会引起______________。
(2)实验中可观察到的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出,_____,_____等。
(3)实验中生成的油状液滴的化学式为____________________。
(4)请写出其中生成一氯甲烷的化学方程式____________________。
(5)用饱和食盐水而不用水的原因是____________________。
【答案】爆炸 试管内黄绿色气体变浅 试管内液面上升 CH2Cl2、CHCl3、CCl4 CH4+Cl2![]() CH3Cl+HCl 降低氯气在水中的溶解度,抑制氯气与水的反应
CH3Cl+HCl 降低氯气在水中的溶解度,抑制氯气与水的反应
【解析】
CH4和Cl2光照条件下发生取代反应生成CH3Cl、CH2Cl2、CHCl3、CCl4和HCl,随着反应进行,Cl2不断被消耗,黄绿色逐渐变浅,生成的CH2Cl2、CHCl3、CCl4常温下是无色油状难溶于水的液体附着在量筒内壁上,生成的HCl极易溶于水,导致量筒内的压强减小,量筒内液面上升,HCl溶于水后,溶液中Cl-浓度增大,使饱和食盐水中有NaCl固体析出。
(1)CH4和Cl2在光照条件下发生取代反应,若用日光直射,反应非常剧烈,可能会引起爆炸,故答案为:爆炸;
(2)甲烷与氯气光照条件下发生取代反应,反应中氯气被消耗导致量筒内颜色变浅,因氯化氢极易溶于水,且反应生成的CH2Cl2、CHCl3、CCl4常温下是无色油状难溶于水的液体,气体物质的量减少使得量筒内的压强减小,量筒内液面上升,因生成的HCl易溶于水,溶液中Cl-浓度增大,使饱和食盐水中有NaCl固体析出,实验中观察到到的现象是:量筒内黄绿色气体颜色变浅,量筒内液面上升,量筒内壁出现油状液滴,饱和食盐水中有少量固体析出,故答案为:量筒内黄绿色气体颜色变浅,量筒内液面上升;
(3)反应生成的CH2Cl2、CHCl3、CCl4常温下是无色油状难溶于水的液体,所以实验中生成的油状液滴的化学式为CH2Cl2、CHCl3、CCl4,故答案为:CH2Cl2、CHCl3、CCl4;
(4)CH4和Cl2光照条件下发生取代反应生成CH3Cl和HCl,反应的化学方程式为CH4+Cl2![]() CH3Cl+HCl,故答案为:CH4+Cl2
CH3Cl+HCl,故答案为:CH4+Cl2![]() CH3Cl+HCl;
CH3Cl+HCl;
(5)氯气在饱和食盐水中的溶解度降低,所以用饱和食盐水而不用水的原因是降低Cl2在水中溶解度,抑制Cl2和水的反应;故答案为:降低Cl2在水中溶解度,抑制Cl2和水的反应。


科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是

A. 放电时,负极反应为3NaBr-2e-==NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-== Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24LH2时,b池生成17.40g Na2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:

(1)N、P、As原子的第一电离能由大到小的顺序为_______;As原子的核外电子排布式为______________。
(2)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
(3)Na3AsO4中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是_________。
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为___g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)在容积为5L的密闭容器中,通入5 mol N2和8 mol H2,在一定条件下反应生成NH3,当反应进行到2 min时,测得容器内有4 mol NH3。则:
(1)2 min时,容器内n(N2)== ________ ,c(H2)== ___________ 。
(2)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为 _______ 。
(二)A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C及B与D分别是同主族元素;已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又知A、C两元素原子序数之和是B、D两元素原子序数之和的一半。请回答下列问题:
(1)写出由A、B、C三元素形成的化合物的电子式__________ ,
(2)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)随原子序数的递增,八种短周期元素x、y、z、d、e、f、g、h原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答下列问题:

① 比较y、z、d的气态氢化物的稳定性强弱是:_______>________>________(用化学式表示)
② 由表中两种元素的原子按1:1组成的化合物A,A中既含离子键又含非极性共价键,其电子式为_____;
③ 下列四种元素的原子序数如下,其中不是和f同一主族的是____________
a.5 b. 21 c. 49 d. 81
④能表示出g和h元素非金属性强弱的离子方程式是______________;能表示出y和h最高价氧化物的水化物的酸性强弱的离子方程式是______________。
(2)F、Cl、Br、I位于周期表的VIIA族。通过下列实验比较出卤族氧化性的强弱。实验如下:

①通过卤素间置换反应比较氧化性强弱的实验是___________。(填写1、2、3、4)
②滴加CCl4的目的是_________________。
③上述实验能否说明氯的氧化性强于溴?判断并说明你的依据__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100 mL0.1mol/L的NaOH溶液中通入一定量的CO2。为探究反应后混合溶液的成分,向其中逐滴加入0.1 mol/L的HCl溶液。溶液产生气体前,消耗V( HCl)=V1;溶液刚好不再产生气体时,消耗V( HCl) =V2。当V1 <V2 <2Vl时,混合溶液中溶质的成分为
A. NaHCO3、Na2CO3 B. NaOH、NaHCO3 C. NaOH、Na2CO3 D. NaOH、Na2CO3、NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL 14.0 molL﹣1浓硝酸中加入足量铜,充分反应后共收集到标准状况下4.48 L NO和NO2混合气体(不考虑NO2与N2O4的相互转化),则参加反应铜的质量为
A. 6.4gB. 12.8gC. 16.0gD. 19.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8 电子稳定结构。下列有关说法正确的是
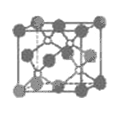
A. 磷化硼晶体的化学式为BP,属于离子晶体
B. 磷化硼晶体中每个原子均形成4个共价键
C. 磷化硼晶体的熔点高,且熔融状态下能导电
D. 磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com