
【题目】常温下向100 mL0.1mol/L的NaOH溶液中通入一定量的CO2。为探究反应后混合溶液的成分,向其中逐滴加入0.1 mol/L的HCl溶液。溶液产生气体前,消耗V( HCl)=V1;溶液刚好不再产生气体时,消耗V( HCl) =V2。当V1 <V2 <2Vl时,混合溶液中溶质的成分为
A. NaHCO3、Na2CO3 B. NaOH、NaHCO3 C. NaOH、Na2CO3 D. NaOH、Na2CO3、NaHCO3
【答案】C
【解析】滴加盐酸V1 mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,盐酸的体积为V2mL,HCO3-+H+=H2O+CO2↑;
A、混合溶液中成分为NaHCO3、Na2CO3 时,逐滴加入盐酸,依次发生反应:![]() 、
、![]() ,假设NaHCO3有amol,Na2CO3有bmol,则刚产生气体时,消耗盐酸的物质的量为bmol,溶液中不再产生气体时,消耗的盐酸的物质的量为(a+2b)mol,对应的溶液体积为2V1 <V2 ,故不选A项;B、 NaOH、NaHCO3溶液不能大量共存,故不选B项;C、混合溶液中成分为NaOH、Na2CO3时,逐滴加入盐酸,依次发生反应:
,假设NaHCO3有amol,Na2CO3有bmol,则刚产生气体时,消耗盐酸的物质的量为bmol,溶液中不再产生气体时,消耗的盐酸的物质的量为(a+2b)mol,对应的溶液体积为2V1 <V2 ,故不选A项;B、 NaOH、NaHCO3溶液不能大量共存,故不选B项;C、混合溶液中成分为NaOH、Na2CO3时,逐滴加入盐酸,依次发生反应:![]() 、
、![]() ,假设NaOH有amol,Na2CO3 有bmol,则刚产生气体时,消耗盐酸的物质的量为(a+b)mol,溶液中不再产生气体时,消耗的盐酸的物质的量为
,假设NaOH有amol,Na2CO3 有bmol,则刚产生气体时,消耗盐酸的物质的量为(a+b)mol,溶液中不再产生气体时,消耗的盐酸的物质的量为![]() ,因此
,因此![]() ,则对应成盐酸所用体积为V1 <V2 <2Vl,故C正确;D、 NaOH、NaHCO3溶液不能大量共存,故不选D项,故选C。
,则对应成盐酸所用体积为V1 <V2 <2Vl,故C正确;D、 NaOH、NaHCO3溶液不能大量共存,故不选D项,故选C。


科目:高中化学 来源: 题型:
【题目】在容积为2.0 L的密闭容器内,物质D在T ℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是

A. 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.0667 mol/(L·min)
B. 该反应的化学方程式为2D(s) 2A(g)+B(g),该反应的平衡常数表达式为K=c(A)2·c(B)
C. 已知:反应的H>0,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D. 若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定含镁3%~5%的铝镁合金中镁的质量分数,设计了2种实验方案,说法不正确的是
方案一:镁铝合金加入足量的氢氧化钠溶液中充分反应后过滤,测定剩余固体质量;
方案二:称量m g铝镁合金粉末,放在图中惰性电热板上,通电使其充分灼烧。测得固体质量增重。
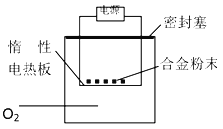
A. 方案一中若称取5.4 g合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中反应,则V≥100 mL
B. 方案一中测定剩余固体质量时,过滤后未洗涤固体就干燥、称量,则镁的质量分数偏高
C. 方案二中欲计算镁的质量分数,实验中还需测定灼烧后固体的质量
D. 方案二中若用空气代替O2进行实验,则测定结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组利用如图所示装置探究甲烷与氯气的反应。根据题意,回答下列问题:

(1)CH4与Cl2发生反应的条件是漫射光照射;若用日光直射,可能会引起______________。
(2)实验中可观察到的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出,_____,_____等。
(3)实验中生成的油状液滴的化学式为____________________。
(4)请写出其中生成一氯甲烷的化学方程式____________________。
(5)用饱和食盐水而不用水的原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的氯气通入含Fe2+、I-、Br-的溶液,溶液中四种粒子的物质的量的变化如图所示。已知b=a+5,线段Ⅳ表示一种含氧酸,且线段I和Ⅳ表示的物质中含有相同的元素。下列说法错误的是

A. 线段I表示I-的变化情况
B. a点时消耗Cl2的体积为134.4 L
C. 原溶液中n(Fe2+):n(Br-) =2:3
D. 线段Ⅳ表明氧化性:C12>HIO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰乙酸乙酯是有机合成中非常重要的原料,实验室制备乙酰乙酸乙酯的反应原理、装置示意图和有关数据如下所示:


实验步骤:
(I)合成:向三颈烧瓶中加入9.8 mL无水乙酸乙酯,迅速加入0.1 g切细的金属钠。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
(II)分离与提纯:
①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
②水层用5 mL无水乙酸乙酯萃取,分液。
③将①②所得有机层合并,洗涤、干燥、蒸馏得到乙酰乙酸乙酯粗产品。
④蒸馏粗产品得到乙酰乙酸乙酯3.9g。
(l)迅速加入金属钠的原因是_________(用化学方程式说明)。
(2)球形冷凝管中冷却水从_____(填“上”或“下”)口进入,上方干燥管中盛有无水CaCl2,其作用是_______。
(3)实验室制备乙酰乙酸乙酯时,通常在无水乙酸乙酯中加入微量的无水乙醇,其作用是_______。
(4)分离与提纯操作①中使用的分离仪器是_______。加入饱和食盐水的作用是_______。
(5)分离与提纯操作③用饱和NaHCO3溶液洗涤的目的是______________。
(6)本实验的产率为______%(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇肉桂酸酯G可用于光刻工艺中作抗腐蚀涂层。下面是一种合成该有机物的路线(部分反应条件及产物已省略):
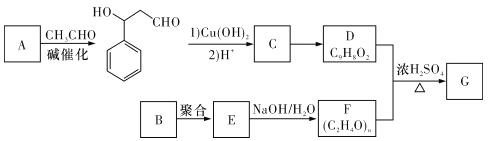
已知以下信息:
I.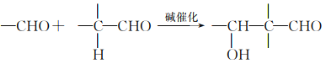 ;
;
Ⅱ.D能使酸性KMnO4溶液褪色;
Ⅲ.同温同压下,实验测定B气体的密度与气态己烷的密度相同,B中含有一个酯基和一个甲基。
请回答下列问题:
(I)A的化学名称是_________。
(2)由C生成D的过程中可能生成多种副产物,其中与D互为同分异构体的有机物的结构简式为______。
(3)B的分子式为__________。
(4)由D和F生成G的化学方程式为_____________。
(5)满足下列条件的C的同分异构体有________种(不考虑立体异构)。
①该有机物是一种二元弱酸,并能使FeC13溶液显色;
②苯环上有三个取代基,并能发生银镜反应。
(6)由D经如下步骤可合成K:
![]()
①H中官能团的名称为 _______________。
②I的结构简式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是
A.电解得到的Cu的物质的量为0.5mol
B.向电解后的溶液中加入98g的Cu(OH)2可恢复为原溶液
C.原混合溶液中c(K+)=4mol/L
D.电解后溶液中c(H+)=2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 一定条件下,乙酸乙酯、淀粉、蛋白质、乙烯都能与水发生水解反应
B. 全降解塑料(![]() )可由单体环氧丙烷(
)可由单体环氧丙烷(![]() )和CO2聚合制得
)和CO2聚合制得
C. 淀粉溶液中加入硫酸,加热4~5 min,再加入少量银氨溶液,加热,有光亮银镜生成
D. 石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com