
����Ŀ��Ϊ�ⶨ��þ3%��5%����þ�Ͻ���þ�����������������2��ʵ�鷽����˵������ȷ����
����һ��þ���Ͻ��������������������Һ�г�ַ�Ӧ����ˣ��ⶨʣ�����������
������������m g��þ�Ͻ��ĩ������ͼ�ж��Ե��Ȱ��ϣ�ͨ��ʹ�������ա���ù����������ء�
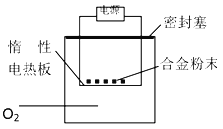
A. ����һ������ȡ5.4 g�Ͻ��ĩ��Ʒ��Ͷ��V mL 2.0 mol/L NaOH��Һ�з�Ӧ����V��100 mL
B. ����һ�вⶨʣ���������ʱ�����˺�δϴ�ӹ�������������þ����������ƫ��
C. ��������������þ������������ʵ���л���ⶨ���պ���������
D. �����������ÿ�������O2����ʵ�飬��ⶨ���ƫ��
���𰸡�A
��������
A.��þΪ5%ʱ���������ĺ��������5.4 g�Ͻ�����������Ϊ5.4����1-5%��g������ݷ�Ӧ��2Al+2NaOH+2H2O=2NaAlO2+3H2����֪��2Al---2NaOH��[5.4����1-5%��]/27��V��10-3��2=2:2�����V=95mL�����ȡ5.4 g�Ͻ��ĩ��Ʒ��Ͷ��V mL 2.0 mol/L NaOH��Һ�з�Ӧ����V��95 mL��A������
B. ����һ�н�����������������Һ��Ӧ�����˺�ʣ�����þ���ⶨʣ���������ʱ�����˺�δϴ�ӹ������������൱��þ������ƫ������þ����������ƫ����B��ȷ��
C.Mg��Al����������Ӧ,���ɽ���������������ⶨ�����������������þ�������غ�������þ�������������غ����з��̿����������þ���������������þ������������C��ȷ��
D. �������е���������������þ�ܹ��뵪����Ӧ���ɵ���þ�����պ������������������þ������ƫ�����ⶨ���ƫ����D��ȷ��
��������������ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��Ϊ������Ԫ����ɵ����ʣ���ת����ϵ���£�

��ش�
��1����XΪ����ɫ���壬Z�ǵ��ʡ�
�����Z��Ԫ�������ڱ��е�λ����_____��
��ȡ����X��ˮ��Ӧ������������ȷ����_____������ĸ����
a���÷�Ӧ��������ԭ��Ӧ
b����Ӧ�����Һ�еμӷ�̪�Լ�����Һ���
c������1 molX�μӷ�Ӧʱ����ת��2mol����
��2����X������Ԫ����ɣ�����һ��Ԫ�ص������������ȵ��Ӳ�����3����һ���ǵؿ��к�������Ԫ�ء�Y��X�����Ԫ����ͬ��
��X��ˮ��Ӧ�Ļ�ѧ����ʽΪ_____��
��X��O2���ͨ��ˮ�У�ǡ������4molZ,��ͨ���XΪ____mol��O2Ϊ____mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵı仯��������Ӽ��������йص��ǣ� ��
A��HF��HCl��HBr��HI�����ȶ������μ���
B�����ʯ��Ӳ�ȴ��ڹ裬���ۡ��е�Ҳ���ڹ�
C��NaF��NaCl��NaBr��Nal���۵����ν���
D��F2��Cl2��Br2��I2���ۡ��е�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ-ѡ��3:���ʽṹ�����ʡ���ͤ���о�С���������ҽ����,����As2O3(�׳���˪)��Ѫ�������Ե��������á���(N)����(P)����(As)�ȶ���VA���Ԫ��,����Ԫ�صĻ��������о�����������������Ҫ��;���ش���������:

(1)N��P��Asԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ_______��Asԭ�ӵĺ�������Ų�ʽΪ______________��
(2)NH3�ķе��PH3_____(���"�͡�)��ԭ����_____________��
(3)Na3AsO4�к��еĻ�ѧ�����Ͱ���_______��AsO43-�Ŀռ乹��Ϊ_______��As4O6�ķ��ӽṹ��ͼ1��ʾ,���ڸû�������As���ӻ���ʽ��_________��
(4)����(P4)�ľ������ڷ��Ӿ��壬�侧���ṹ��ͼ2(СԲȦ��ʾ������)����֪�����ı߳�Ϊacm�������ӵ�����ΪNAmol-1����þ����к��е�Pԭ�ӵĸ���Ϊ______���þ�����ܶ�Ϊ___g��cm-3(�ú�NA��a��ʽ�ӱ�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ӦA+B��C�����ȣ����������Т�A+B��X�����ȣ�����X��C�����ȣ�������ʾ��ͼ�У�����ȷ��ʾ�ܷ�Ӧ�����������仯����_____��

��2���ϳɰ���ҵ�У��ϳ�����ÿ����2mol NH3���ų�92.2kJ��������֪����ͼ������1mol N��H���������յ�����Լ����_____kJ��

��3���뽫 Zn+2Ag+��2Ag+Zn2+��Ƴ�ԭ��أ�����������װ��ͼ����ע���缫�����Լ��������Һ___��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Y�ι���һ�������������������������Ͽ��Խ���ijЩʵ��̽����������ͼװ�ÿ���̽��SO2��BaCl2��Ӧ����BaSO3�����������������ж���ȷ����

A. e��f�����е��Լ����Էֱ���Ũ��ˮ��NaOH����
B. �����ܵ���������ͨ������ʹ�����е�����������ƿ�����뷴Ӧ
C. c��d�������ܶ��������BaCl2��Һ�У���֤������Ba2+��ֽӴ�
D. Y�ι����в�����Ϊ���������壬��BaSO3����ΪBaSO4����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(һ)���ݻ�Ϊ5L���ܱ������У�ͨ��5 mol N2��8 mol H2����һ�������·�Ӧ����NH3������Ӧ���е�2 minʱ�������������4 mol NH3����
(1)2 minʱ��������n(N2)== ________ ��c(H2)== ___________ ��
(2)2 minʱ������������������ʵ����뷴Ӧǰ����������������ʵ���֮��Ϊ _______ ��
(��)A��B��C��D���ֶ�����Ԫ�أ����ǵ�ԭ������������������A��C��B��D�ֱ���ͬ����Ԫ�أ���֪B��D��Ԫ�ؼ���γ�DB2��DB3���ֻ����������Է����������16����֪A��C��Ԫ��ԭ������֮����B��D��Ԫ��ԭ������֮�͵�һ�롣��ش��������⣺
(1)д����A��B��C��Ԫ���γɵĻ�����ĵ���ʽ__________ ��
(2)��A��B��C��D����Ԫ���γɵ�����X�������ᷴӦ�ܹ����ɾ��д̼�����ζ�����壬д��X�����ᷴӦ�����ӷ���ʽ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������100 mL0.1mol/L��NaOH��Һ��ͨ��һ������CO2��Ϊ̽����Ӧ������Һ�ijɷ֣���������μ���0.1 mol/L��HCl��Һ����Һ��������ǰ������V( HCl)=V1����Һ�պò��ٲ�������ʱ������V( HCl) =V2����V1 <V2 <2Vlʱ�������Һ�����ʵijɷ�Ϊ
A. NaHCO3��Na2CO3 B. NaOH��NaHCO3 C. NaOH��Na2CO3 D. NaOH��Na2CO3��NaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Թ�ҵ��ˮ��������ˮ���д����Ƿ�ֹˮ����Ⱦ������ˮ�ʵ���Ҫ��ʩ֮һ��
(1)���᳧�����Է�ˮ����(As)Ԫ��(��Ҫ��H3AsO3��ʽ����)�������ߣ�Ϊ��������ŷţ�ij�������û�ѧ���������������ˮ����ش��������⣺
����֪���ǵ���ͬ��Ԫ�أ��ȵ�ԭ�Ӷ�2�����Ӳ㣬����Ԫ�����ڱ���λ��Ϊ____________��
�ڹ�ҵ�ϲ�����(ͨ��������)ȥ����ˮ�е��飬������Ϊ�����Ե������飬�÷�Ӧ�����ӷ���ʽΪ_____________________��
(2)��Ƴ��ķ�ˮ�к��е�CN-�о綾����Ҫ���������ŷš�������CN-��ˮ�ķ���֮һ��������������£�CN-������������HCO3-��ͬʱ����NH3���÷�Ӧ�����ӷ���ʽΪ_____________��
(3)������������������������Һ��ͬʱ�õ������ԭ����ͼ��ʾ(ͼ�С�HA����ʾ������ӣ�A-��ʾ���������)��
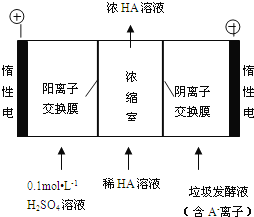
�������ĵ缫��ӦʽΪ________________________��
�ڼ���Ũ�����еõ�Ũ�����ԭ����________________________��
�۵������У���ȡһ���Ĵ�ʩ�ɿ��������ҵ�pHԼΪ6��8����ʱ����Ũ���ҵ�OH-�ɺ��Բ��ơ�400 mL 10 g/L ������Һͨ��һ��ʱ���Ũ������Ϊ145 g/L(��Һ����仯���Բ���)�������ϲ�����H2�ڱ�״���µ����ԼΪ________L(��ʾ�������Ħ������Ϊ90 g/mol)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com