
【题目】下列说法中正确的是![]()
![]()
![]() 杂化轨道是由同一个原子中能量最近的s轨道和p轨道混合起来形成的一组能量相同的新轨道
杂化轨道是由同一个原子中能量最近的s轨道和p轨道混合起来形成的一组能量相同的新轨道
![]() 同一周期从左到右,元素的第一电离能、电负性都是越来越大
同一周期从左到右,元素的第一电离能、电负性都是越来越大
![]() 分子中键能越大,表示分子拥有的能量越高
分子中键能越大,表示分子拥有的能量越高
![]() 所有的配合物都存在配位键
所有的配合物都存在配位键
![]() 所有含极性键的分子都是极性分子
所有含极性键的分子都是极性分子
![]() 熔融状态下能导电的化合物一定是离子化合物
熔融状态下能导电的化合物一定是离子化合物
![]() 所有的原子晶体都不导电
所有的原子晶体都不导电
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
【答案】D
【解析】①sp3杂化轨道是由同一个原子中能量最近的1个s轨道和3个p轨道混合起来形成的一组能量相同的新轨道;②同周期从左到右,元素的第一电离能呈增大趋势,第IIA族大于第IIIA族、第VA族大于第VIA族;③分子中键能越大,表明形成化学键时放出的能量越多,意味着化学键越稳定;④通常把金属离子(或原子)与某些分子或离子以配位键形成的化合物称为配合物;⑤含极性键的分子可能是极性分子如H2O、NH3等,也可能是非极性分子如CO2、CH4等;⑥熔融状态下能导电的化合物一定是离子化合物;⑦有的原子晶体能导电如锗等。
①只有同一原子中能量相近的不同类型的原子轨道才能杂化,sp3杂化轨道是由同一个原子中能量最近的1个s轨道和3个p轨道混合起来形成的一组能量相同的新轨道,①正确;②同周期从左到右,元素的第一电离能呈增大趋势,第IIA族大于第IIIA族、第VA族大于第VIA族,同周期从左到右电负性逐渐增大,②错误;③分子中键能越大,表明形成化学键时放出的能量越多,意味着化学键越稳定,③错误;④通常把金属离子(或原子)与某些分子或离子以配位键形成的化合物称为配合物,所有配合物中都存在配位键,④正确;⑤含极性键的分子可能是极性分子如H2O、NH3等,也可能是非极性分子如CO2、CH4等,⑤错误;⑥离子化合物中含阴、阳离子,共价化合物中含原子或分子,熔融状态下能导电的化合物一定是离子化合物,⑥正确;⑦有的原子晶体能导电如锗等,⑦错误;正确的有①④⑥,答案选D。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】(一)在容积为5L的密闭容器中,通入5 mol N2和8 mol H2,在一定条件下反应生成NH3,当反应进行到2 min时,测得容器内有4 mol NH3。则:
(1)2 min时,容器内n(N2)== ________ ,c(H2)== ___________ 。
(2)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为 _______ 。
(二)A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C及B与D分别是同主族元素;已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又知A、C两元素原子序数之和是B、D两元素原子序数之和的一半。请回答下列问题:
(1)写出由A、B、C三元素形成的化合物的电子式__________ ,
(2)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 1s电子云界面图是一个球面,表示在这个球面以内,电子出现的概率为![]()
B. 在能层、能级、以及电子云的伸展方向确定时,电子的运动状态才能确定下来
C. 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
D. 原子核外的电子就像行星围绕太阳一样绕着原子核做圆周运动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸厂的酸性废水中砷(As)元素(主要以H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为____________。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反应的离子方程式为_____________________。
(2)电镀厂的废水中含有的CN-有剧毒,需要处理加以排放。处理含CN-废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为_____________。
(3)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子):
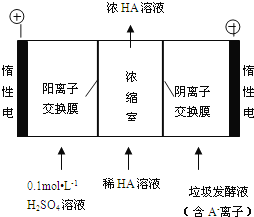
①阳极的电极反应式为________________________。
②简述浓缩室中得到浓乳酸的原理:________________________。
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 g/L 乳酸溶液通电一段时间后,浓度上升为145 g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为________L(提示:乳酸的摩尔质量为90 g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知:氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。活泼金属硫化物与酸反应产生H2S气体。
Ⅰ、制备氢化锂:选择下图中的装置制备氢化锂(有些装置可重复使用):
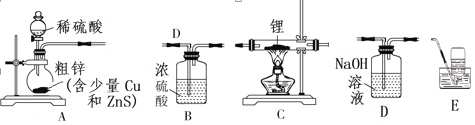
(1)装置的连接顺序(从左至右)为A→___________________________________。
(2)检查好装置的气密性,打开装置A中分液漏斗的活塞后,点燃酒精灯前需进行的实验操作是________。
Ⅱ、制备氢化铝锂
1947年,Schlesinger、Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(3)写出氢化锂与无水三氯化铝反应的化学方程式_________________________。
Ⅲ.测定氢化铝锂产品(不含氢化锂)的纯度
(4)按下图连接好装置后,检查装置气密性的操作是:_____________________。装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是__________________。
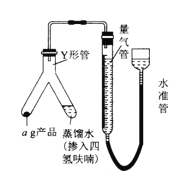
(5)在标准状况下,反应前量气管(由碱式滴定管改装而成)读数为V1 mL,反应完毕并冷却之后,量气管读数为V2 mL。该样品的纯度为_________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将_________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8 电子稳定结构。下列有关说法正确的是
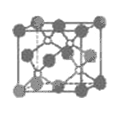
A. 磷化硼晶体的化学式为BP,属于离子晶体
B. 磷化硼晶体中每个原子均形成4个共价键
C. 磷化硼晶体的熔点高,且熔融状态下能导电
D. 磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化加氢可生成 3-甲基己烷的是( )
A.CH2=CHCH(CH3)CH2CH2CH3
B.CH2=C(CH3)CH2CH2CH2CH3
C.CH3C(CH2CH3)=CHCH3
D.CH3CH2CH2C(CH3)=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | p | |||||||||||||||
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子外围电子排布式:____。
(2)c与a形成6个原子组成分子结构简式:__________,该分子是:_______(填“极性”或“非极性”)分子。
(3)表中O、P两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态P2+再失去一个电子难。对此,你的解释是__________________________;
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
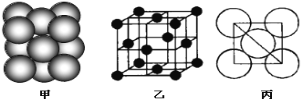
晶胞中i原子的配位数为___________,一个晶胞中i原子的数目为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一混合溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100 mL该溶液进行如下实验:
,现取三份100 mL该溶液进行如下实验:
(1)向第一份溶液中加入AgNO3溶液时有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液并加热后,收集到气体0.06 mol;
(3)向第三份溶液中加入足量BaCl2溶液后,所得沉淀经洗涤、干燥、称量为8.24 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
根据上述实验,以下推测正确的是( )
A. K+可能存在 B. 100 mL溶液中含0.01 mol ![]()
C. Cl可能存在 D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com