
【题目】下列有关能量转换的说法正确的是( )
A.煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
科目:高中化学 来源: 题型:
【题目】已知反应:C(s)+H2O(g)![]() CO(g)+H2 (g) ΔH>0, 某温度下,向5 L密闭容器中加入2 mol C(s)与1 mol H2O(g),t1 s时,CO的物质的量为0.20 mol,到第t2 s时恰好达到平衡,此时CO的物质的量为0.35 mol ,下列说法正确的是( )
CO(g)+H2 (g) ΔH>0, 某温度下,向5 L密闭容器中加入2 mol C(s)与1 mol H2O(g),t1 s时,CO的物质的量为0.20 mol,到第t2 s时恰好达到平衡,此时CO的物质的量为0.35 mol ,下列说法正确的是( )
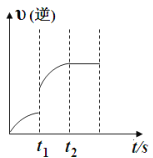
A. t1时改变的条件可能是使用催化剂
B.t1时改变的条件可能是增大 H2O 浓度
C.t1~t2这段时间内的化学反应速率 v(H2O)= 0.15/(t2-t1)
D.t2后继续加入 2 mol C(s)平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应aA(g)cC(g)+dD(g),压缩容积到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a<c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液,
(1)混合溶液中共有 种(填数字)不同的粒子。
(2)这些粒子中,浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(3)物质的量之和为0.01mol的两种粒子是__________________。
(4) 和 两种粒子数量之和比OH-多0.008mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的应用正确的是( )
A. 液氨汽化时要吸收大量的热,可用作制冷剂
B. 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
C. 生石灰能与水反应,可用来干燥氯气
D. 氯化铝是一种电解质,可用电解法制铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些资料认为:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
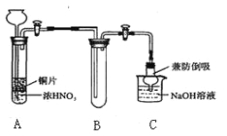
(1)小组甲同学设计实验如下:
①试管A中反应的化学方程式是 。
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的小木条迅速伸进试管内,发现木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的。为准确达到实验目的,需在A、B之间增加一个装置,该装置的作用是 。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;余烬木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是 。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:①2NO+Na2O2=2NaNO2
②6NaNO2+3H2SO4=3Na2SO4+2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①B中观察到的主要现象是 ,F装置的作用是 。
②在反应前,打开弹簧夹,通入一段时间N2,目的是 。
③充分反应后,检验D装置中反应产物的实验方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如下:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 molL-1 H2C2O4 溶液 | 30 mL 0.01 molL-1 KMnO4 酸性溶液 |
② | 20 mL 0.2 molL-1 H2C2O4 溶液 | 30 mL 0.01 molL-1 KMnO4 酸性溶液 |

(1)检验上图装置气密性的最简便方法为:____________。
(2)H2C2O4溶液与酸性 KMnO4溶液反应的化学方程式为____________。
(3)该实验探究的是___________因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是___________(填实验序号)。
(4)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________(若忽略溶液混合前后体积的变化)。
(5)小组同学发现反应速率总是如上右图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①__________、②_________、③K+对该反应有催化作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3molA和2.5molB混合与2L密闭容器中,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
(1)x= 。
(2)平衡时C的浓度为多少?(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素aA、bB、cC、dD、eE的原子的结构示意图分别为
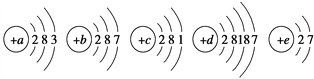
请回答下列问题:
(1)属于同周期的元素是__________(填元素符号,下同),属于同主族的元素__________。
(2)金属性最强的元素是__________,非金属性最强的元素是__________。
(3)上述元素中最高价氧化物对应的水化物碱性最强的是__________。(填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com