
【题目】亚磷酸(H3PO3)是二元弱酸,亚磷酸主要用作尼龙增白剂,电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图(其中阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列说法不正确的是

A. 阳极的电极反应式为2H2O-4e-![]() 4H++O2↑
4H++O2↑
B. 产品室中发生的离子反应为HPO32-+2H+![]() H3PO3
H3PO3
C. 原料室中Na+浓度保持不变
D. 阴极室中溶液的pH逐渐升高
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是( )
A.甲烷在空气中燃烧B.用光照射甲烷和氯气的混合气体
C.乙烯制备聚乙烯D.乙烯通入到溴的四氯化碳溶液,溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )

A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)为第五周期元素,与氧同主族,其单质和化合物在化工生产等方面具有广泛应用。
(1)画出碲的原子结构示意图___________________。
(2)已知TeO2微溶于水,易溶于较浓的强酸和强碱。写出TeO2溶于浓氢氧化钠溶液的离子方程式_________________________。
(3)工业上用铜阳极泥(主要成分为Cu2Te,还含有少量的Ag、Au)为原料制备单质碲的工艺流程如下:

①“加压浸出”过程中被氧化的元素为_____________(填元素符号),1molCu2Te被“浸出”时氧化剂得到的电子数为___________________。
②“酸浸”时,温度过高会使碲的浸出率降低,原因为____________________。
③“还原”过程的化学方程式为____________________。
④工业上还可以将铜阳极泥煅烧、碱浸后得到Na2TeO3溶液,然后再通过电解的方法得到单质碲,阴极的电极反应式为______________________ 。
(4)25℃时,向1mol·L-1的Na2TeO3溶液中滴加盐酸,当溶液pH约为6时,此时溶液中c(HTeO3-):c(TeO32-)=_____________。(H2TeO3的Ka1=1.0×10-3,Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20g/3。
⑴此浓盐酸的物质的量浓度是多少?_______________(列式计算)
⑵配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL? ______________(列式计算)
⑶用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号):_____________________ 。
①计算②装瓶③用50mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
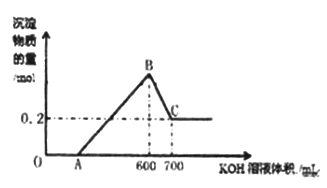
(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com