
����Ŀ����(Te)Ϊ��������Ԫ�أ�����ͬ���壬�䵥�ʺͻ������ڻ��������ȷ�����й㷺Ӧ�á�
��1�������ڵ�ԭ�ӽṹʾ��ͼ___________________��
��2����֪TeO2����ˮ�������ڽ�Ũ��ǿ���ǿ�д��TeO2����Ũ����������Һ�����ӷ���ʽ_________________________��
��3����ҵ����ͭ������(��Ҫ�ɷ�ΪCu2Te��������������Ag��Au)Ϊԭ���Ʊ������ڵĹ�������������

�١���ѹ�����������б�������Ԫ��Ϊ_____________(��Ԫ�ط���)��1molCu2Te����������ʱ�������õ��ĵ�����Ϊ___________________��
�ڡ������ʱ���¶ȹ���ʹ�ڵĽ����ʽ��ͣ�ԭ��Ϊ____________________��
�ۡ���ԭ�����̵Ļ�ѧ����ʽΪ____________________��
����ҵ�ϻ����Խ�ͭ���������ա������õ�Na2TeO3��Һ��Ȼ����ͨ�����ķ����õ������ڣ������ĵ缫��ӦʽΪ______________________ ��
��4��25��ʱ����1mol��L-1��Na2TeO3��Һ�еμ�����������ҺpHԼΪ6ʱ����ʱ��Һ��c(HTeO3-)��c(TeO32-)=_____________��(H2TeO3��Ka1=1.0��10-3��Ka2=2.0��10-8)
���𰸡� 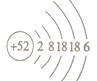 TeO2+2OH-=TeO32-+H2O Cu��Te 8NA(��4.816��1024) �¶����ߣ�����ӷ�����Ӧ��Ũ�Ƚ��ͣ����½����ʽ��� TeCl4+2SO2+4H2O=Te��+4HCl+2H2SO4 TeO32-+3H2O+4e-=Te+6OH- 50��1
TeO2+2OH-=TeO32-+H2O Cu��Te 8NA(��4.816��1024) �¶����ߣ�����ӷ�����Ӧ��Ũ�Ƚ��ͣ����½����ʽ��� TeCl4+2SO2+4H2O=Te��+4HCl+2H2SO4 TeO32-+3H2O+4e-=Te+6OH- 50��1
����������1����(Te)Ϊ��������Ԫ�أ�����ͬ���壬��ԭ������Ϊ��52������ԭ�ӵ����Ų�Ϊ��2 8 18 18 6��ԭ�ӽṹʾ��ͼΪ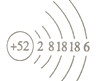 ��
��
��2����֪�����ڽ�Ũ��ǿ���ǿ���һ���������������������ƣ���TeO2����Ũ����������Һ�����ӷ���ʽΪ��TeO2+2OH-=TeO32-+H2O��
��3������������ͼ������ѹ�������õ���CuSO4��Һ��TeO2��ͭ��������Ҫ�ɷ�ΪCu2Te����Ϊ0�ۣ��ʸù�����Cu��Te������������1molCu2Te����������ʱ������2mol CuSO4 ת��4mol���Ӻ�1mol TeO2 ת��4mol���ӣ���1molCu2Te����������ʱ�������õ��ĵ�����Ϊ8NA��4.816��1024��
���������ʱ����Ũ���ὫTeO2ת����TeCl4���¶ȹ��ߣ�����ӷ�����Ӧ��Ũ�Ƚ��ͣ����½����ʽ��ͣ�
�ۡ���ԭ��������SO2��TeCl4��ԭ�ɵ���Te���ʸ÷�Ӧ�ķ���ʽΪ��TeCl4+2SO2+4H2O=Te��+4HCl+2H2SO4��
�ܹ�ҵ�ϻ����Խ�ͭ���������ա������õ�Na2TeO3��Һ��Ȼ����ͨ�����Na2TeO3��Һ�ķ����õ������ڣ�����������ԭ��Ӧ����Ԫ�ػ��ϼ�Ҫ���ͣ�����Te��+4�۽���0�ۣ��ʵ缫��ӦΪ��TeO32-+3H2O+4e- =Te+6OH-��
��4��25��ʱ����1mol��L-1��Na2TeO3��Һ�еμ�����������ҺpHԼΪ6ʱ��c��H+��=10-6mol/L��H2TeO3��Ka2=![]() =2.0��10-8����c(HTeO3-)��c(TeO32-)=50��1��
=2.0��10-8����c(HTeO3-)��c(TeO32-)=50��1��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʹֲ��ϸ������������ϸ���к��Ĺ��������֬�ʹ���������MDA�������������绯ø��SOD���ܹ�������������Ӷ���ǿֲ��Ŀ����ԡ��о���Ա�����ˡ�ˮ�����ˮ�����翹���Ե�Ӱ�족ʵ�飬ʵ�鲽�輰��������ʾ��
��� | ���� | �����¶� /�� |
|
1 | ����ˮ���� | 25 | 7��3 |
2 | �� | �� | 9��4 |
3 | 0��5 mmol/Lˮ���ώ�� | 5 | 10��3 |
4 | 1��0 mmol/Lˮ���ώ�� | 5 | 11��6 |
5 | 1��5 mmol/Lˮ���ώ�� | 5 | 13��6 |
6 | 2��0 mmol/Lˮ���ώ�� | 5 | 8��5 |
7 | 2��5 mmol/Lˮ���ώ�� | 5 | 7��9 |
8 | 3��0 mmol/Lˮ���ώ�� | 5 | 6��5 |
��1���������� ������ ���������Ϊ ��ʵ�����ʱÿ��ȡ50��ˮ�����磬������1�꣬Ŀ���� ��
��2����ʵ���Ա���Ϊ �� ����Ҫ���Ƶ��ر����� �� ������д��������
��3�����1��2���տɵõĽ����� ���Ա����2��8�ɵõĽ����� ��
��4����5 ��Ļ����£����ʵ���Ũ��Ϊ2��0 mmol/L��ˮ�����ˮ�����翹���Ե�Ӱ���� �����ǿ������������
��5�������5 �������µ�ʵ�������ˮ����Ũ�ȡ�SOD���Թ�ϵ����������ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A(g)+B(g)![]() C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
�¶�/ �� | 700 | 800 | 830 | 1000 | 1200 |
ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830��ʱ����һ��2 L���ܱ������г���0.2mol��A��0.8mol��B����Ӧ��ʼ4 s��A��ƽ����Ӧ����v(A)=0.005mol/(L��s)������˵����ȷ����
A��4 sʱc(B)Ϊ0.76mol/L
B��830����ƽ��ʱ��A��ת����Ϊ80%
C����Ӧ��ƽ��������¶ȣ�ƽ�������ƶ�
D��1200��ʱ��ӦC(g)+D(g��![]() A(g)+B(g)��ƽ�ⳣ����ֵΪ0.4
A(g)+B(g)��ƽ�ⳣ����ֵΪ0.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���õ�ⷨ���ᴿ����ij�ּصĺ�����������(������ء�̼��ص�)�Ĵ�KOH��Һ���乤��ԭ����ͼ��ʾ��
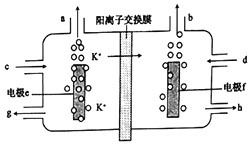
����˵����ȷ���ǣ� ��
A. �缫fΪ�������缫e��H+������ԭ��Ӧ
B. �缫e�ĵ缫��ӦʽΪ4OH--4e-=2H2O+O2��
C. d��������KOH��Һ��g��������KOH��Һ
D. b��ÿ����11.2L���壬����1molK+���������ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(H3PO3)�Ƕ�Ԫ����,��������Ҫ������������,���Na2HPO3��ҺҲ�ɵõ�������,װ��ʾ��ͼ��ͼ(������Ĥֻ����������ͨ��,��Ĥֻ����������ͨ��)������˵������ȷ����

A. �����ĵ缫��ӦʽΪ2H2O-4e-![]() 4H++O2��
4H++O2��
B. ��Ʒ���з��������ӷ�ӦΪHPO32-+2H+![]() H3PO3
H3PO3
C. ԭ������Na+Ũ�ȱ��ֲ���
D. ����������Һ��pH������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaN3)����������ˮ�������Ҵ������������ѣ���������ȫ�����е���Ҫ�ɷ֣����ڷ�����ײ��˲��ֽ�����������彫���ҹ��𡣹�ҵ��NaN3 ���Ʊ����������У���Ӧ����ʽ������
��.2Na+2NH3![]() 2NaNH2+H2
2NaNH2+H2
��.NaNH2+N2O![]() NaN3+H2O
NaN3+H2O
ʵ������������װ ��ģ�ҵ��NaN3���Ʊ���

�ش�����������
ʵ�����Ʊ�
��1��װ��C��ʢ�ŵ�ҩƷΪ____________________��װ��D�н�����ԡ������ˮԡ����Ҫԭ����_______________________��
��2��N2O����NH4NO3��240��245�� �ֽ��Ƶ�(����淋��۵�Ϊ169.6��)�����ѡ������巢��װ����__________________(ͼ�м���װ������ȥ)���÷�Ӧ�Ļ�ѧ����ʽΪ______________�����Ʊ�NaN3��ʵ������У����۲쵽_______________ʱ��ʼͨ��N2O��

ʵ���������ᴿ
��Ӧ��ȫ������ȡ��װ��D�еĻ����������²������õ�NaN3������

��֪��NaNH2����ˮ��Ӧ����NaOH �Ͱ���
��3����������������ϴ�ӵ�ԭ����________________________��
ʵ���������ⶨ
ʵ�����õζ����ⶨ����������Ʒ��NaN3����������������2.500 g�������500.00 mL��Һ����ȡ50.00 mL��Һ������ƿ�У�����50.00 mL 0.1010 mol��L-1(NH4)2Ce(NO3)6 ��Һ������ַ�Ӧ����Һ��ϡ�ͣ�����Һ�м���8 mLŨ����������3���ڷ�����ָʾҺ����0.0500 mol��L-1(NH4)2Fe(SO4)2����Һ�ζ�������Ce4+��������Һ���Ϊ29.00mL���ⶨ���̵ķ�Ӧ����ʽΪ��2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2��
Ce4++Fe2+=Ce3++Fe3+��
��4�����Ƶ���������Һʱ�������õ��ձ�������������Ͳ�⣬���õ��IJ���������_____________��
��5��������NaN3����������Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2-������ϩ��(����������)��һ����Ҫ��ҽҩ�м��塢�����м��壬�乤ҵ�ϳɷ���(��F��ʼ�������ϳ�·��)���£�

��֪��i. ![]()
ii. ![]()
iii. 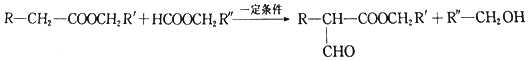
�ش��������⣺
��1��C������Ϊ_____________����Ӧ�ܵķ�Ӧ����Ϊ___________________��
��2������E�Ƿ���ȫת��ΪF���Լ���________________________��
��3����Ӧ�۵Ļ�ѧ����ʽΪ_______________________��
��4��D��ͬ���칹���ж��֣���������������D��ͬ���칹����______________�����б����ϵ�һԪȡ������2�ֵĽṹ��ʽΪ___________________ ��
���ܷ���������Ӧ ������FeCl3��Һ������ɫ��Ӧ
�ۺ˴Ź������ķ������Ϊ6��2��2��1��1
��5��·�߶���·��һ��Ȳ�̫���룬������_____________________��
��6�����������ϳ�·�ߣ����һ����CH3COOH�Ʊ�HOOCCH2COOH�ĺϳ�·�ߡ����ϳ�·�ߵı�ʾ����Ϊ��A![]() B����
B����![]() Ŀ����___________________
Ŀ����___________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�CH4��H2O(g)������Ӧ��CH4(g)+H2O(g)![]() CO(g)+3H2(g)������ʼ
CO(g)+3H2(g)������ʼ![]() =Z���ں�ѹ�£�ƽ��ʱ
=Z���ں�ѹ�£�ƽ��ʱ![]() (CH4)�����������Z��T(�¶�)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
(CH4)�����������Z��T(�¶�)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
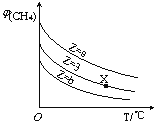
A���÷�Ӧ���ʱ��H>0
B��ͼ��Z�Ĵ�СΪa>3>b
C��ͼ��X���Ӧ��ƽ��������![]() =3
=3
D���¶Ȳ���ʱ��ͼ��X���Ӧ��ƽ���ڼ�ѹ��![]() (CH4)��С
(CH4)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���й����ʵĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | H2CO3 | H2SO3 |
����ƽ�ⳣ�� | K=1.8��10��5 | K1=4.3��10��7 K2=5.6��10��11 | K1=1.5��10��2 K2=1.02��10��7 |
(1)��д��H2SO3�ĵ���ƽ�ⳣ��K1�ı���ʽ��________________��
(2) �����£������Ϊ10mL pH=2�Ĵ�����Һ����������Һ�ֱ������ˮϡ����1000mL��ϡ�ͺ���Һ��pH��ǰ��_____���ߣ����������������=������
(3)һ�������£��������ˮϡ��������Һ��������I���ˮ���V�仯��������ͼ��ʾ����a��b��c������Һ����ĵ���̶��ɴ�СΪ____________________��
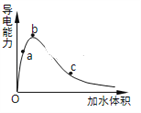
(4)��������CH3COO����CO32����HSO3����SO32������Һ�н��H���������ɴ�С�Ĺ�ϵΪ___________��
(5)�����ͬ��c(H��)��ͬ�Ģ�CH3COOH����HCl����H2SO4 ��������Һ�ֱ���ͬŨ�ȵ�NaOH��Һ��ȫ�к�ʱ������NaOH��Һ������ɴ�С������˳����_____(�����)��
(6)��֪��H��(aq) + OH��(aq) == H2O(l) ��H =��57.3 kJ/mol��ʵ����ϡ������ϡNaOH��Һ��Ӧ����1 mol H2Oʱ�ų�57 kJ���ȣ��������Һ�У����������Ȼ�ѧ����ʽΪ________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com