
【题目】在化学科学研究中,物质发生化学反应的反应热可通过实验测定,也可通过化学计算的方式间接地获得。
(1)实验方法测反应反应热
①中和热测定
实验中所需要使用的玻璃仪器除烧杯、量筒外还需要___________、___________。
为了减少实验误差:实验过程中将NaOH溶液________(选填“一次”或“分多次”)倒入盛有盐酸的小烧杯中;溶液混合后,准确读取混合溶液的________,记为终止温度。
②实验测定在一定温度下,0.2 molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33 kJ的热量。该反应的热化学方程式_________________________________。
(2)通过化学计算间接获得
①已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。
则反应H2(g)+I2(g)=2HI(g)的反应热△H=________kJ·mol-1
②工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H=-90.8 kJ·mol-1。
已知:2H2(g)+ O2(g) = 2H2O (l) △H=-571.6 kJ·mol-1
H2(g)+![]() O2(g) = H2O(g) △H=-241.8 kJ·mol-1
O2(g) = H2O(g) △H=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为__________kJ·mol-1;
CH3OH(g)+O2(g) = CO(g)+2H2O(g) △H=_______kJ·mol-1
【答案】温度计 环形玻璃搅拌棒 一次 最高温度 CH4(g)+2H2O(g) =CO2(g)+4H2(g) △H=+165.0 kJ·mol-1 -9 285.8 -392.8
【解析】
(1)①中和热测定
实验中所需要使用的玻璃仪器除烧杯、量筒外还需要温度计 环形玻璃搅拌棒。
为了减少实验误差:实验过程中将NaOH溶液一次倒入盛有盐酸的小烧杯中;溶液混合后,准确读取混合溶液的最高温度,记为终止温度。
②实验测定在一定温度下,0.2 molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33 kJ的热量,则1molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33kJ×1mol÷0.2mol=165 kJ的热量,该反应的热化学方程式CH4(g)+2H2O(g) =CO2(g)+4H2(g) △H=+165.0 kJ·mol-1。
⑵通过化学计算间接获得
①已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ,则反应H2(g)+I2(g)=2HI(g)的反应热△H=反应物的键能总和-生成物的键能总和=436kJ/mol+153kJ/mol-2×299kJ/mol=-9 kJ·mol-1。
②工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H1=-90.8 kJ·mol-1。
已知:2H2(g)+ O2(g) = 2H2O (l) △H2=-571.6 kJ·mol-1
H2(g)+![]() O2(g) = H2O(g) △H3=-241.8 kJ·mol-1
O2(g) = H2O(g) △H3=-241.8 kJ·mol-1
根据上述反应,2molH2完全燃烧生成H2O(l)放出571.6kJ的热量,1molH2完全燃烧生成H2O(l)放出285.8kJ的热量,H2燃烧热为285.8kJ·mol-1;根据盖斯定律,CH3OH(g)+O2(g) = CO(g)+2H2O(g) △H=-△H1+2△H3=90.8kJ/mol+2×(-241.8kJ/mol)=-392.8kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.液态HCl不导电,所以HCl是非电解质
B.NH3、CO2的水溶液能导电,所以NH3、CO2是电解质
C.铜、石墨均能导电,所以它们都是电解质
D.蔗糖在水溶液中或熔融时均不导电,所以是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
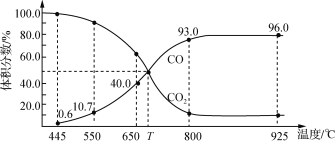
下列说法正确的是
A.650 ℃时,反应达平衡后CO2的转化率为25.0%
B.550 ℃时,若充入惰性气体,υ(正)、υ(逆)均减小,平衡不移动
C.T ℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925 ℃时,此反应的平衡常数K=2304,保持温度不变,若缩小体积,K值将变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.1mol硝基(-NO2)与46gNO2所含的电子数均为23NA
B.1mol环己烷中含有共价键数为12NA
C.向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,转移的电子数为NA
D.电解精炼铜时,若转移了NA个电子,则阳极质量减小32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡是最重要的化学反应原理之一。
(1)现有容积为1L的恒温恒容密闭容器,向其中加入1molA气体和1molB气体后发生反应:A(g)+B(g)![]() C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题:
C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题:
①在题干条件下,说明该反应已经达到平衡状态的有__(填序号)。
A.消耗0.1molA的同时生成0.1molC
B.容器中气体的压强不随时间而变化
C.容器中气体的密度不随时间而变化
D.A的转化率为50%
②保持容器温度和容积不变,若开始时向容器中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1、Q2与q的数值关系正确的是___(填序号)。
A.Q1+Q2=q B.Q1+2Q2<q C.Q1+2Q2>q D.Q1+Q2<q
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入amolA气体,重新达平衡后,B气体的转化率为75%,则a=__。
(2)在一容积可变的密闭容器中充有10molCO和20molH2,发生CO(g)+2H2(g)![]() CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①A、B、C三点的平衡常数KA、KB、KC的大小关系为___。
②若达到平衡状态A时,容器的体积为8L,则在平衡状态B时容器的体积为___L。
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。则电源的正极为___(填“A”或“B”),写出阳极的电极反应式___。
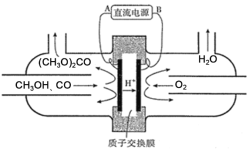
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组利用废铁屑(含少量硫等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O],并设计了如图所示的装置(夹持仪器略去)。

称取一定量的表面除去油污的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60℃热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)相比通常铁与稀硫酸生成氢气的条件,在实验中选择50~60℃热水浴的原因是___;锥形瓶中溶液冷却至室温后再加入氨水的原因__。
(2)C瓶中KMnO4溶液的作用是__。
(3)若要确保获得浅绿色悬浊液,下列符合实验要求的是__(填字母)。
a.保持铁屑过量
b.控制溶液呈强碱性
c.将稀硫酸改为浓硫酸
(4)莫尔盐是一种重要化学药品,较绿矾稳定,不易被空气氧化,是化学分析中常用的基准物之一。其组成可用(NH4)2SO4FeSO46H2O或(NH4)2Fe(SO4)26H2O表示。一定条件下,(NH4)2Fe(SO4)2发生分解:4(NH4)2Fe(SO4)2=2Fe2O3+5SO2↑+3SO3↑+N2↑+6NH3↑+7H2O下列叙述正确的是__。
a反应生成amolN2时,转移电子的物质的量为6amol
b该反应的还原产物是硫的两种氧化物
c有amol电子转移时,生成SO2的物质的量为0.1amol
d将气体产物用足量BaCl2溶液吸收,只得到一种沉淀物
(5)实验探究:影响溶液中Fe2+稳定性的因素。
配制0.8mol/L的FeSO4溶液(pH=4.5)和0.8mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2ml上述溶液于两支试管中,刚开始两种溶液都呈浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,过了一会儿观察可见(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.6 | 2.7 |
完全沉淀pH | 9.6 | 3.7 |
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其它条件相同时,在一定pH范围内,溶液pH越小Fe2+稳定性越好。
假设3:___。
(6)称取ag所制得的硫酸亚铁铵晶体,用加热煮沸的蒸馏水溶解,配成250mL溶液,取出25mL放入锥形瓶中,用cmol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为___(用含c、V、a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置进行化学反应X+2Y![]() 2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是
2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是

①该反应为放热反应;②该反应为吸热反应;③生成物的总能量比反应物的总能量更高;④反应物的总能量比生成物的总能量更高;⑤该反应过程可以看成是“贮存“于X、Y内部的部分能量转化为热能而释放出来。
A. ①④⑤ B. ①④ C. ①③ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.红褐色固体![]() 全部溶于氢碘酸:
全部溶于氢碘酸:![]()
B.水杨酸溶于![]() 溶液中:
溶液中:![]()
C.将等浓度的![]() 溶液与
溶液与![]() 液按体积比2:3混合:
液按体积比2:3混合:![]()
D.洁厕灵(含![]() )与84消毒液混合后产生氯气:
)与84消毒液混合后产生氯气:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=__________。
(2)0~2 s内该反应的平均速率v(NO)=__________, v(O2)=__________。
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体 b.增大O2的浓度
c.扩大容器体积 d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com