
ЁОЬтФПЁП(1)дкБъзМзДПіЯТЃЌЬхЛ§ЮЊ11.2L ЕФSO2ЫљКЌOдзгЪ§ЮЊ__________ЁЃ
(2)9gЫЎгы_________gСђЫсЫљКЌЕФЗжзгЪ§ЯрЕШЃЌЫќУЧЫљКЌбѕдзгЪ§жЎБШЪЧ__________ЁЃ
(3)дк2H2SЃЋSO2===2H2OЃЋ3SЗДгІжабѕЛЏВњЮягыЛЙдВњЮяЕФЮяжЪЕФСПжЎБШЮЊ__________ЁЃ
(4)ТШЦјгаЖОЃЌЪЕбщЪвГЃгУNaOHШмвКЮќЪеЖргрЕФТШЦјЃЌЗДгІЕФРызгЗНГЬЪНЮЊ
______________________________ЃЛНЋЩйСПЕФCO2ЭЈШыДЮТШЫсИЦШмвКжаЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ__________________________________________________________________________ЃЛ
(5) ХфЦНЯТСаЛЏбЇЗНГЬЪН___NH3 + ___O2 === ___NO + ___H2O
(6) ЧыдкЯТСаЛЏбЇЗНГЬЪНЩЯгУЫЋЯпЧХЗЈБъГіЕчзгзЊвЦЕФЗНЯђКЭЪ§ФП 8NH3 ЃЋ 3Cl2 === 6NH4Cl ЃЋ N2__________________________________ ЁЃ
ЁОД№АИЁПNA 49 1:4 2:1 Cl2+2OHЉЈTClЉ+ClOЉ+H2O Ca2+ + 2ClO- + H2O + CO2 = CaCO3Ё§ + 2HClO 4 5 4 6 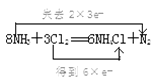
ЁОНтЮіЁП
ЃЈ1ЃЉБъПіЯТЃЌЦјЬхФІЖћЬхЛ§ЪЧ22.4L/molЖўбѕЛЏСђЕФЮяжЪЕФСП=![]() =0.5molЃЌжЪСП=0.5molЁС64g/mol=32gЃЌЗжзгЪ§=0.5molЁСNA/mol=0.5NAЃЌУПИіЗжзгжаКЌгаСНИіOдзгЃЌЫљвдЦфбѕдзгИіЪ§ЮЊNAЃЛ
=0.5molЃЌжЪСП=0.5molЁС64g/mol=32gЃЌЗжзгЪ§=0.5molЁСNA/mol=0.5NAЃЌУПИіЗжзгжаКЌгаСНИіOдзгЃЌЫљвдЦфбѕдзгИіЪ§ЮЊNAЃЛ
ЃЈ2ЃЉnЃЈH2OЃЉ=![]() =0.5molЃЌгЩn=
=0.5molЃЌгЩn=![]() =
=![]() ПЩжЊЃЌЗжзгЪ§жЎБШЕШгкЮяжЪЕФСПжЎБШЃЌдђmЃЈH2SO4ЃЉ=0.5molЁС98g/mol=49gЃЌгЩЗжзгзщГЩПЩжЊЃКЫќУЧЫљКЌбѕдзгЪ§жЎБШЪЧ1ЃК4ЃЛ
ПЩжЊЃЌЗжзгЪ§жЎБШЕШгкЮяжЪЕФСПжЎБШЃЌдђmЃЈH2SO4ЃЉ=0.5molЁС98g/mol=49gЃЌгЩЗжзгзщГЩПЩжЊЃКЫќУЧЫљКЌбѕдзгЪ§жЎБШЪЧ1ЃК4ЃЛ
ЃЈ3ЃЉдкSO2+2H2S=2H2O+3SЁ§ЗДгІжаЃЌSO2жаSдЊЫиЕФЛЏКЯМлгЩ+4НЕЕЭЮЊ0ЃЌЮЊбѕЛЏМСЃЛH2SжаSдЊЫиЕФЛЏКЯМлгЩ-2Щ§ИпЕН0ЃЌЮЊЛЙдМСЃЌдђSЕЅжЪМШЪЧбѕЛЏВњЮягжЪЧЛЙдВњЮяЃЌгЩSдзгЪиКуМАЗДгІПЩжЊЃЌ2molЛЙдМСЗДгІЩњГЩбѕЛЏВњЮяЮЊ2molЃЌ1molбѕЛЏМСЗДгІЩњГЩЛЙдВњЮяЮЊ1molЃЌЫљвдбѕЛЏВњЮягыЛЙдВњЮяЕФЮяжЪЕФСПжЎБШЮЊ2molЃК1mol=2ЃК1ЃЛ
ЃЈ4ЃЉТШЦјКЭЧтбѕЛЏФЦШмвКЗДгІЩњГЩТШЛЏФЦЁЂДЮТШЫсФЦКЭЫЎЃЌРызгЗДгІЗНГЬЪНЮЊCl2+2OH=Cl-+ClO-+H2OЃЛ
ЃЈ5ЃЉЕЊдЊЫиЕФЛЏКЯМлгЩ-3МлЩ§ИпЕН+2МлЃЌЖјбѕдЊЫиЕФЛЏКЯМлгЩ0МлНЕЕЭЕН-2МлЃЌИљОнЕУЪЇЕчзгЪ§ФПЯрЕШПЩжЊЖўепМЦСПЪ§жЎБШЮЊ4ЃК5ЃЌЙЪNOЕФЯЕЪ§ЪЧ4ЃЌвРОнЧтдЊЫиЪиКуЕУжЊЫЎЮЊ6ЃЌЙЪД№АИЮЊЃК4ЁЂ5ЁЂ4ЁЂ6ЃЛ
ЃЈ6ЃЉ8NH3ЃЋ3Cl2 =6NH4ClЃЋN2ЗДгІжаЃЌClдЊЫиЕФЛЏКЯМлДг0МлНЕЕЭЕН-1МлЃЌЙВЕУЕН6ИіЕчзгЃЛNдЊЫиЕФЛЏКЯМлВПЗжДг-3МлЩ§ИпЕН0МлЃЌЙВЪЇШЅ6ИіЕчзгЃЌгУЫЋЯпЧХБэЪОЮЊ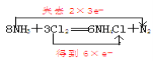 ЁЃ
ЁЃ


 ЪРМЭАйЭЈжїЬхПЮЬУаЁбЇПЮЪБЭЌВНДяБъЯЕСаД№АИ
ЪРМЭАйЭЈжїЬхПЮЬУаЁбЇПЮЪБЭЌВНДяБъЯЕСаД№АИ ЪРМЭАйЭЈгХСЗВтЯЕСаД№АИ
ЪРМЭАйЭЈгХСЗВтЯЕСаД№АИ АйЗжбЇЩњзївЕБОЬтСЗЭѕЯЕСаД№АИ
АйЗжбЇЩњзївЕБОЬтСЗЭѕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁАРрЭЦЫМЮЌЁБЪЧЛЏбЇНтЬтжаГЃгУЕФЫМЮЌЗНЗЈЃЌРрЭЦЕФНсТлзюжевЊОЙ§ЪЕМљЕФМьбщЃЌВХФмОіЖЈЦфе§ШЗгыЗёЁЃЯТСаРрЭЦНсТлжае§ШЗЕФЪЧ
A.ФЦгыЫЎЗДгІЩњГЩNaOHКЭH2ЃЛЫљгаН№ЪєгыЫЎЗДгІЖМЩњГЩМюКЭH2
B.ТСдкПеЦјжаЩњГЩбѕЛЏФЄБЃЛЄФкВуН№ЪєЃЛЬњдкПеЦјжаЩњГЩбѕЛЏФЄвВБЃЛЄФкВуН№Ъє
C.Al(OH)3ЁЂCu(OH)2ЪмШШвзЗжНтЃЛFe(OH)3ЪмШШвВвзЗжНт
D.FeгыCuSO4ШмвКЗДгІФмжУЛЛCuЃЛNaгыCuSO4ШмвКЗДгІвВФмжУЛЛCu
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯТСаИїзщРызгвЛЖЈФмдкжИЖЈШмвКжаДѓСПЙВДцЕФЪЧЃЈ ЃЉ
A. ЪЙЗгЬЊБфКьЩЋЕФШмвКжаЃКNaЃЋЁЂAl3ЃЋЁЂSO42ЃЁЂClЃ
B. ![]() =1ЁС10Ѓ13molЁЄLЃ1ЕФШмвКжаЃКNH4ЃЋЁЂCa2ЃЋЁЂClЃЁЂNO3Ѓ
=1ЁС10Ѓ13molЁЄLЃ1ЕФШмвКжаЃКNH4ЃЋЁЂCa2ЃЋЁЂClЃЁЂNO3Ѓ
C. гыAlЗДгІФмЗХГіH2ЕФШмвКжаЃКFe2ЃЋЁЂKЃЋЁЂNO3ЃЁЂSO42Ѓ
D. ЫЎЕчРыЕФc(HЃЋ)=1ЁС10Ѓ13molЁЄLЃ1ЕФШмвКжаЃКKЃЋЁЂNaЃЋЁЂAlO2ЃЁЂCO32Ѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛжжШлШкЬМЫсбЮШМСЯЕчГидРэЪОвтШчЭМЁЃЯТСагаЙиИУЕчГиЕФЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
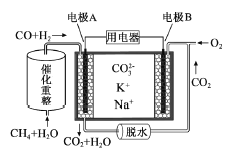
A. ЗДгІCH4ЃЋH2O![]() 3H2ЃЋCO,УПЯћКФ1molCH4зЊвЦ12mol Ечзг
3H2ЃЋCO,УПЯћКФ1molCH4зЊвЦ12mol Ечзг
B. ЕчМЋAЩЯH2ВЮгыЕФЕчМЋЗДгІЮЊЃКH2ЃЋ2OHЃЃ2eЃ=2H2O
C. ЕчГиЙЄзїЪБЃЌCO32ЃЯђЕчМЋBвЦЖЏ
D. ЕчМЋBЩЯЗЂЩњЕФЕчМЋЗДгІЮЊЃКO2ЃЋ2CO2ЃЋ4eЃ=2CO32Ѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋH2SзЊЛЏЮЊПЩдйРћгУЕФзЪдДЪЧФмдДбаОПСьгђЕФживЊПЮЬтЁЃ
ЃЈ1ЃЉH2SЕФзЊЛЏ
Ђё | ПЫРЭЫЙЗЈ |
|
Ђђ | ЬњбЮбѕЛЏЗЈ |
|
Ђѓ | ЙтЗжНтЗЈ |
|
Ђй ЗДгІЂёЕФЛЏбЇЗНГЬЪНЪЧ________ЁЃ
Ђк ЗДгІЂђЃК____+ 1 H2S ==____Fe2+ + ____SЁ§ + ____ЃЈНЋЗДгІВЙГфЭъећЃЉЁЃ
Ђл ЗДгІЂѓЬхЯжСЫH2SЕФЮШЖЈадШѕгкH2OЁЃНсКЯдзгНсЙЙНтЪЭЖўепЮШЖЈадВювьЕФдвђЃК_______ЁЃ
ЃЈ2ЃЉЗДгІЂѓСђЕФВњТЪЕЭЃЌЗДгІЂђЕФдзгРћгУТЪЕЭЁЃЮвЙњПЦбаШЫдБЩшЯыНЋСНИіЗДгІёюКЯЃЌЪЕЯжгЩH2SИпаЇВњЩњSКЭH2ЃЌЕчзгзЊвЦЙ§ГЬШчЭМЁЃ

Й§ГЬМзЁЂввжаЃЌбѕЛЏМСЗжБ№ЪЧ______ЁЃ
ЃЈ3ЃЉАДееЩшМЦЃЌПЦбаШЫдБбаОПШчЯТЁЃ
Ђй ЪзЯШбаОПЙ§ГЬввЪЧЗёПЩааЃЌзАжУШчЭМЁЃОМьбщЃЌnМЋЧјВњЩњСЫFe3+ЃЌpМЋВњЩњСЫH2ЁЃnМЋЧјВњЩњFe3+ЕФПЩФмдвђЃК

ЂЁЃЎFe2+ - e- = Fe3+
ЂЂЃЎ2H2O -4e-=O2 +4H+ЃЌ_______ЃЈаДРызгЗНГЬЪНЃЉЁЃОШЗШЯЃЌЂЁЪЧВњЩњFe3+ЕФдвђЁЃЙ§ГЬввПЩааЁЃ
Ђк ЙтееВњЩњFe3+КѓЃЌЯђnМЋЧјзЂШыH2SШмвКЃЌгаSЩњГЩЃЌГжајВњЩњЕчСїЃЌpМЋВњЩњH2ЁЃбаОПSВњЩњЕФдвђЃЌЩшМЦШчЯТЪЕбщЗНАИЃК______ЁЃ ОШЗШЯЃЌSЪЧгЩFe3+бѕЛЏH2SЫљЕУЃЌH2SВЛФмжБНгЗХЕчЁЃЙ§ГЬМзПЩааЁЃ
ЃЈ4ЃЉзлЩЯЃЌЗДгІЂђЁЂЂѓФмёюКЯЃЌЭЌЪБФмИпаЇВњЩњH2КЭSЃЌЦфЙЄзїдРэШчЭМЁЃ

НјвЛВНбаОПЗЂЯжЃЌГ§СЫFe3+/Fe2+ ЭтЃЌI3-/I- вВФмЪЕЯжШчЭМЫљЪОбЛЗЙ§ГЬЁЃНсКЯЛЏбЇгУгяЃЌЫЕУїI3-/I- ФмЙЛЪЙSдДдДВЛЖЯВњЩњЕФдвђЃК________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖдгкCH3COOHЃЋCH3CH2OH![]() CH3COOCH2CH3ЃЋH2OЗДгІЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
CH3COOCH2CH3ЃЋH2OЗДгІЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
A. ХЈСђЫсВЛЪЧЗДгІЮяB. ХЈСђЫсзїДпЛЏМСC. ЪєгкШЁДњЗДгІD. ЪєгкМгГЩЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІЕФФмСПБфЛЏЧщПіЗћКЯШчЭМЕФЪЧЃЈ ЃЉ
A. ИпЮТЯТЃЌФОЬПгыCO2ЗДгІЩњГЩCO
B. ЩњЪЏЛвгыЫЎЗДгІ
C. ЯѕЫсгыЧтбѕЛЏФЦШмвКЕФЗДгІ
D. МзЭщдкбѕЦјжаШМЩе
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЛЏбЇЗДгІдРэХаЖЯе§ШЗЕФЪЧ( )
A.ШєвЛЖЈЬѕМўЯТЃЌЗДгІ![]() ДяЦНКтКѓЃЌбЙЫѕШнЦїЃЌдђЗДгІЮяХЈЖШдіДѓЃЌЦНКте§ЯђвЦЖЏ
ДяЦНКтКѓЃЌбЙЫѕШнЦїЃЌдђЗДгІЮяХЈЖШдіДѓЃЌЦНКте§ЯђвЦЖЏ
B.вбжЊЫЎКЯыТ(![]() )ЪЧЖўдЊШѕМюЃЌФмЗЂЩњРрЫЦгкЖрдЊЫсЕФЕчРыаЮЪНЃЌдђдкЫЎжаЫќЕФЕкЖўВНЕчРыЗНГЬЪНЮЊ
)ЪЧЖўдЊШѕМюЃЌФмЗЂЩњРрЫЦгкЖрдЊЫсЕФЕчРыаЮЪНЃЌдђдкЫЎжаЫќЕФЕкЖўВНЕчРыЗНГЬЪНЮЊ![]()
C.ЭЌЮТЭЌбЙЯТЃЌ![]() дкЙтееКЭЕуШМЬѕМўЯТЕФ
дкЙтееКЭЕуШМЬѕМўЯТЕФ![]() ВЛЭЌ
ВЛЭЌ
D.дквЛЖЈЬѕМўЯТЕФ![]() ШмвКЃЌШєЩ§ИпЮТЖШЃЌдђ
ШмвКЃЌШєЩ§ИпЮТЖШЃЌдђ![]() МѕаЁ
МѕаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгЩЗМЯуЬўMКЯГЩФГгаЛњЮяNЕФвЛжжСїГЬШчЯТЃК

вбжЊВПЗжаХЯЂШчЯТЃК
Ђй![]()
![]()
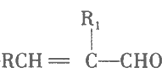 +H2O
+H2O
Ђк 
![]()
Ђл ![]()
![]()
![]()
ЧыЛиД№ЯТСаЮЪЬтЃК
(1)MЗжзгзюЖрга_______________ИідзгЙВЦНУцЁЃ
(2)CжаКЌгаЕФЙйФмЭХУћГЦЪЧ__________ЃЛФмВтЖЈCжаКЌЙйФмЭХжжРрЕФвЧЦїУћГЦЪЧ____________________________ЁЃ
(3)EЕФНсЙЙМђЪНЮЊ______________________
(4)FКЭGЗДгІЩњГЩNЕФЛЏбЇЗНГЬЪНЮЊ_________________________________________ЁЃ
(5)TЪЧFЕФЭЌЗжвьЙЙЬхЃЌTЭЌЪБОпБИЯТСаЬѕМўЕФНсЙЙга________________________жжЁЃ
ЂйФмгыаТжЦЧтбѕЛЏЭзЧвКЙВШШВњЩњКьЩЋЙЬЬхЃЛ
ЂкКЌЬМЬМШ§МќЃЛ
ЂлгіТШЛЏЬњШмвКЗЂЩњЯдЩЋЗДгІЁЃ
(6)вдБћЯЉЮЊдСЯКЯГЩ![]() ЃЌЩшМЦКЯГЩТЗЯпЃК_______________ЃЈШмМСКЭЮоЛњЪдМСШЮбЁЃЉЁЃ
ЃЌЩшМЦКЯГЩТЗЯпЃК_______________ЃЈШмМСКЭЮоЛњЪдМСШЮбЁЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com