
【题目】由芳香烃M合成某有机物N的一种流程如下:

已知部分信息如下:
①![]()
![]()
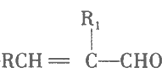 +H2O
+H2O
② 
![]()
③ ![]()
![]()
![]()
请回答下列问题:
(1)M分子最多有_______________个原子共平面。
(2)C中含有的官能团名称是__________;能测定C中含官能团种类的仪器名称是____________________________。
(3)E的结构简式为______________________
(4)F和G反应生成N的化学方程式为_________________________________________。
(5)T是F的同分异构体,T同时具备下列条件的结构有________________________种。
①能与新制氢氧化铜浊液共热产生红色固体;
②含碳碳三键;
③遇氯化铁溶液发生显色反应。
(6)以丙烯为原料合成![]() ,设计合成路线:_______________(溶剂和无机试剂任选)。
,设计合成路线:_______________(溶剂和无机试剂任选)。
【答案】17 碳碳双键和醛基 红外光谱仪 
![]() +
+![]()
![]()
 13 CH3CH=CH2
13 CH3CH=CH2![]() CH3CHBrCHBr
CH3CHBrCHBr![]() CH3C≡CH
CH3C≡CH![]()
![]()
【解析】
由题中信息可知,M经臭氧氧化等反应生成A和B,A和B分别是苯甲醛和乙醛中的一种;A和B可以发生醛分子间的缩合反应生成C,则C为![]() ;C发生银镜反应后再酸化生成D,则D为
;C发生银镜反应后再酸化生成D,则D为![]() ;D与溴发生加成反应生成E,E为
;D与溴发生加成反应生成E,E为 ;E再发生消去反应、酸化后生成F,F为
;E再发生消去反应、酸化后生成F,F为![]() ;F和G合成N,根据信息③可以推断G为
;F和G合成N,根据信息③可以推断G为![]() 。
。
(1)根据苯环12原子共面、乙烯6原子共面、单键可以旋转,M分子最多有17个原子共平面。
(2)C(![]() )中含有的官能团名称是碳碳双键和醛基;能测定C中含官能团种类的仪器是红外光谱仪。
)中含有的官能团名称是碳碳双键和醛基;能测定C中含官能团种类的仪器是红外光谱仪。
(3)E的结构简式为 。
。
(4)F和G反应生成N的化学方程式为![]() +
+![]()
![]()
 。
。
(5)T是F(![]() )的同分异构体,T同时具备下列条件:
)的同分异构体,T同时具备下列条件:
①能与新制氢氧化铜浊液共热产生红色固体,说明T有醛基;
②含碳碳三键;
③遇氯化铁溶液发生显色反应,说明T有酚羟基。
满足以上条件的结构有:苯环上有两个侧链,分别是—C≡C—CHO和—OH,按邻、间、对排列3种情况;苯环上有—C≡CH、—CHO —OH等3个侧链,3个侧链在苯环有10种排列方式。综上所述,共有13种。
(6)以丙烯为原料合成![]() ,先将丙烯与溴加成生成1.2-二溴丙烷,然后1.2-二溴丙烷发生消去反应生成丙炔,最后丙炔和丙烯合成
,先将丙烯与溴加成生成1.2-二溴丙烷,然后1.2-二溴丙烷发生消去反应生成丙炔,最后丙炔和丙烯合成![]() 。设计合成路线如下:CH3CH=CH2
。设计合成路线如下:CH3CH=CH2![]() CH3CHBrCHBr
CH3CHBrCHBr![]() CH3C≡CH
CH3C≡CH![]()
![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定的溶液中一定能大量共存的是
A. ![]() 溶液:
溶液:![]()
B. 使酚酞呈红色的溶液中:![]()
C. ![]() =1×1014的溶液:
=1×1014的溶液:![]()
D. 由水电离![]() 的的溶液:
的的溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列混合物分别可以用什么方法分离
酒精与水_____________,NaCl与泥沙________,KNO3与NaCl_____ ,溴水提取溴________ 。
(2)甲烷的电子式________,乙烯的结构式 ________________,乙炔空间构型_____________,苯分子中_________(有或无)碳碳双键,所以苯________ (能或不能)使高锰酸钾褪色
(3)可以用______(化学式)溶液检验苯酚的存在,现象是溶液呈__________乙醛与新制的氢氧化铜共热现象是___________生成。
(4)在乙醇的化学性质中,各反应的断键方式可概括如下:(填序号)

消去反应:______ ;与金属反应:_______;催化氧化:___________; 与HX反应:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
| IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素②的原子结构示意图为_____。
(2)元素③、④、⑤、⑥原子半径由大到小为_____。
(3)上述 8 种元素中,非金属性最强的是_____。
(4)元素②、③形成的气态氢化物稳定性:_____>_____;元素①、③、⑤可形成既含离子键又含极性共价键的化合物,写出其电子式:_____。
(5)元素⑦的最高价氧化物对应的水化物与元素⑤最高价氧化物对应的水化物溶液反应的离子方程式为_____。
(6)写出金属铜与②最高价氧化物对应的水化物稀溶液反应的离子方程式_____。
(7)从原子结构的角度解释元素③和⑦的非金属性强弱:_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B. 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C. 用0.2000 molL-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 molL-1),当pH=7时,溶液中的酸恰好完全中和
D. 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 molL-1盐酸、③0.1 molL-1氯化镁溶液、④0.1 molL-1硝酸银溶液中,Ag+浓度:④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行铝热反应实验,发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究该褐色硬块的组成。请回答下列问题:

(l)铝热反应原理____________(写化学方程式);试剂A为_____(写化学式)。实验现象:_________、有褐色固体生成。
(2)将褐色硬块处理成粉未状,研究小组首先排除了含有单质Al杂质的可能性。
实验方法:首先取少量粉未加入_____溶液中;
实验现象:__________;实验结论是:粉末中含有Al2O3而没有Al。
(3)根据上述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3。提出假设:
假设l:固体粉末中除Al2O3外还有Fe;
假设II:固体粉末中除Al2O3外还有Fe和Fe2O3。
设计方案并实验:
实验步骤 | 实验现象 | 实验结论 |
①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设II不成立 |
②再滴入几滴0.01mol/L KSCN 溶液 | 溶液不变色 |
你认为上述结论是否合理,_________,理由是_______________。
(4)取上述实验所得溶液,滴入适量氯水溶液变红色。此时涉及的离子反应方程式为:_________________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用浓盐酸与氯酸钾固体反应制氯气时,发现所得气体颜色偏深,经分析该气体主要含有Cl2和ClO2两种气体,某研究性学习小组拟用如图所示装置分离制得的混合气体,并测定两种气体的物质的量之比。

Ⅰ.查阅资料:
常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不溶于浓硫酸、四氯化碳,有强氧化性,能与NaOH溶液反应生成等物质的量的两种盐,其中一种为 NaClO3。
Ⅱ.制备与分离:
(1)实验加药品前应进行的实验操作是____________。
(2)装置C、E的作用分别是 _________、_________。
(3)F中ClO2与NaOH 溶液反应的离子方程式为_____________。
Ⅲ.测量与计算:
反应结束后,测得B、C装置分别增重 2.0g和 14 .2g,将D中的液体溶于水,配成2.5 L溶液,取 25.00 mL该溶液,调节试样的pH﹤2.0 ,加入足量的 KI晶体,振荡后,静置片刻;加入指示剂X ,用 0.200mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25.00 mL 。(己知: 2ClO2+8H++10I-===5I2+2Cl-+4H2O;2Na2S2O3+I2===Na2S4O6 +2NaI )
(4)指示剂X为_____,滴定终点时的现象是_______________。
(5)原装置收集到的ClO2物质的量为___________。
Ⅳ.结论:
(6)浓盐酸与氯酸钾固体反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苧烯有新鲜橙子香气,结构简式为:![]() 。回答下列问题:
。回答下列问题:
(1)苧烯的分子式为_________。下列有关苧烯的说法正确的是________
a.苧烯属于芳香烃 b.苧烯与1,3-丁二烯互为同系物
c.苧烯分子中键角均为120° d.苧烯不能发生1,4-加成反应
(2)有机物A是苧烯的同分异构体,分子中含有两个六元环,能使溴水褪色,一氯代物只有两种,则A的结构简式为______________。碳原子上连有 4 个不同的原子或基团时,该碳称为手性碳,写出苧烯的结构简式,用星号(*)标出苧烯中的手性碳________________。
(3)苧烯在较高温度下分解为异戊二烯,异戊二烯发生加聚反应得到4种聚异戊二烯,其结构简式为 、
、 、__________、___________。
、__________、___________。
(4)苧烯通过下列路径可以制备松油醇:
![]()
反应①属于__________________(填反应类型),反应②条件是_______________。松油醇与苯甲酸发生反应的化学方程式为_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com