
【题目】如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( ) 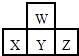
A.原子半径的大小顺序是Z>Y>X>W
B.Z的气态氢化物比X的气态氢化物稳定
C.X,Y,Z各元素最高价和最低价的绝对值之和为8
D.X,Y,Z最高价氧化物对应水化物的酸性强弱关系Z>Y>X
【答案】A
【解析】解:图是周期表中短周期的一部分,则X位于第三周期,X原子最外层电子数比次外层电子数少3,推知X为P,则W、Y、Z依次为O、S、Cl,则
A.同周期元素从左到右原子半径逐渐减小,同主族元素原子半径从上到下逐渐增大,则原子半径X>Y>Z>W,故A错误;
B.周期表中,同周期元素从左到右元素的非金属性逐渐增强,则非金属性Y>X,可知Z的氢化物比X的氢化物稳定,故B正确;
C.X、Y、Z各元素最高正价分别为+5、+6、+7,最低负价分别为﹣3、﹣2、﹣1,化合价的绝对值的和均为8,故C正确;
D.同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物对应水化物的酸性逐渐增强,则X、Y、Z最高价氧化物对应水化物的酸性强弱关系Z>Y>X,故D正确;
故选A.


科目:高中化学 来源: 题型:
【题目】现有硫酸钠、硫酸铝、硫酸镁三种无色的溶液,可用一种试剂将它们区别开来,该试剂是( )
A. 蒸馏水 B. 盐酸 C. 氢氧化钠溶液 D. 硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯水加热到较高温度时,下列叙述正确的是
A.水的离子积变大、pH变小、呈酸性
B.水的离子积不变、pH变大、呈中性
C.水的离子积变小、pH变小、呈碱性
D.水的离子积变大,pH变小、呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氯代烃中不能由烯烃与氯化氢加成直接得到的有
A.氯代环已烷B.2,2-二甲基-1-氯丙烷
C.2-甲基-2-氯丙烷D.2,2,4,4-四甲基-3-氯戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列液体中,滴入水中会出现分层现象,但在滴入热的氢氧化钠溶液中时分层现象会逐渐消失的是(不考虑有机物的挥发)( )
A. 溴乙烷 B. 乙醇 C. 苯 D. 苯乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017东城区二模】CO2经催化加氢可合成乙烯:2CO2 (g)+6H2(g)C2H4(g)+4H2O(g).0.1MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图.下列叙述不正确的是( )
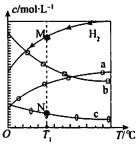
A.该反应的△H<O
B.曲线b代表H2O
C.N点和M点所处状态的c(H2)不一样
D.其它条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了两组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,D、E、F三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸条.已知常温下浓盐酸与高锰酸钾能反应生成氯气. 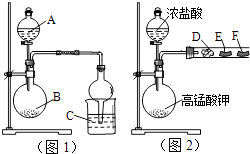
(1)甲同学实验中选用的物质名称为:A , B;C处反应的离子方程式为: .
(2)乙同学的实验中圆底烧瓶中发生反应的化学方程式为;E处的实验现象为 , F处的实验现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016四川] 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时CH4的体积分数
=Z,在恒压下,平衡时CH4的体积分数![]() (CH4)与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)与Z和T(温度)的关系如图所示。下列说法正确的是

A.该反应的焓变ΔH>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:aA(g)+bB(g)![]() cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)反应的化学方程式中,a∶b∶c为_______;
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为______________;
(3)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是_______,其值是_______;
(4)由第一次平衡到第二次平衡,平衡移动的方向是_______,采取的措施是_______;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2_______T3(填“>”“<”或“=”),判断的理由是______________;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10 min后达到新的平衡,请在下图中用曲线表示第Ⅳ阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com