
【题目】通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。已知乙二酸晶体加热分解的方程式为:H2C2O42H2O ![]() 3H2O + CO2↑+ CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
3H2O + CO2↑+ CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
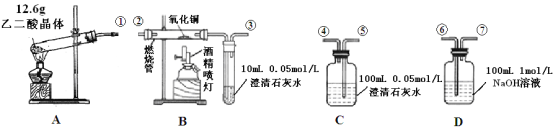
(1)检验装置A气密性的方法是___________________________________________
(2)按气流方向连接各仪器,用数字表示接口的连接顺序: ①→_________________;
(3)证明CO存在的实验现象是_______________________________________________;
(4)本实验尾气处理的方法是_______________________________________;
(5)根据题给的数据,假设反应产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),D中溶质及对应的物质的量是_______________。
【答案】连好装置,①处接长导管,将导管伸入盛有水的烧杯中,用手握住试管观察,若导管口产生连续气泡,松开手有小段水柱回流,则装置A气密性良好 ⑤④⑥⑦②③ B装置中黑色氧化铜变红,澄清石灰水变浑浊,则含CO 在导管③后放置一个燃着的酒精灯(或用气囊收集) 0.01mol Na2CO3和0.08mol NaHCO3
【解析】
(1)根据检查装置气密性的方法及注意事项分析即可,装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置的气密性;
(2)乙二酸晶体加热分解生成CO2和CO,此实验是验证反应产物中含有CO2和CO(装置不能重复使用),要验证二氧化碳与一氧化碳的存在,首先利用澄清石灰来验证二氧化碳的存在,然后除去二氧化碳再验证一氧化碳的存在;
(3)一氧化碳与氧化铜反应生成二氧化碳,二氧化碳可使澄清石灰水变浑浊;
(4)一氧化碳有毒,具有可燃性,燃烧生成无毒的二氧化碳;
(5)B、C中澄清石灰水均先变浑浊,后又变澄清,说明二氧化碳与氢氧化钙发生:CO2+Ca(OH)2=CaCO3↓+H2O、CO2+H2O+CaCO3=Ca(HCO3)2,则D装置发生:CO2+2NaOH=Na2CO3+H2O、CO2+H2O+Na2CO3=2NaHCO3。
(1)检查装置的气密性原理是根据装置内外的压强差形成水柱或气泡,所以检验装置气密性的方法是:连好装置,①处接长导管,将导管伸入盛有水的烧杯中,用手握住试管观察,若导管口产生连续气泡,松开手有小段水柱回流,则装置A气密性良好,故答案为:连好装置,①处接长导管,将导管伸入盛有水的烧杯中,用手握住试管观察,若导管口产生连续气泡,松开手有小段水柱回流,则装置A气密性良好;
(2)乙二酸晶体加热分解生成CO2和CO,装置A中的①导出气体,此实验是验证反应产物中含有CO2和CO(装置不能重复使用),应首先验证二氧化碳①→⑤→④,然后除去二氧化碳④→⑥→⑦,验证二氧化碳的方法是:把气体通入澄清的石灰水,澄清石灰水变浑浊,则含有二氧化碳;然后除去二氧化碳,二氧化碳与氢氧化钠反应除去,剩余为一氧化碳,验证一氧化碳存在⑦→②→③,一氧化碳与氧化铜反应生成二氧化碳,然后通入澄清石灰水,澄清石灰水变浑浊,则含有一氧化碳,故答案为:⑤④⑥⑦②③;
(3)一氧化碳与氧化铜反应CuO+CO ![]() Cu+CO2,反应生成二氧化碳,B装置中黑色氧化铜变红,B中澄清石灰水变浑浊,则含CO,故答案为:B装置中黑色氧化铜变红,澄清石灰水变浑浊,则含CO;
Cu+CO2,反应生成二氧化碳,B装置中黑色氧化铜变红,B中澄清石灰水变浑浊,则含CO,故答案为:B装置中黑色氧化铜变红,澄清石灰水变浑浊,则含CO;
(4)一氧化碳有毒,具有可燃性,尾气处理的方法是点燃,2CO+O2![]() 2CO2,一氧化碳燃烧生成二氧化碳,所以在导管③后放置一个燃着的酒精灯(或用气囊收集),故答案为:在导管③后放置一个燃着的酒精灯(或用气囊收集);
2CO2,一氧化碳燃烧生成二氧化碳,所以在导管③后放置一个燃着的酒精灯(或用气囊收集),故答案为:在导管③后放置一个燃着的酒精灯(或用气囊收集);
(5)12.6gH2C2O42H2O的物质的量为n=m÷M=12.6g÷126g/mol=0.1mol,乙二酸晶体加热分解生成的一氧化碳、二氧化碳的物质的量分别为:0.1mol、0.1mol,反应产生的气体全部排出,并与吸收液充分反应,C装置中n(Ca(OH)2)=cV=0.05mol/L×0.1L=0.005mol,CO2+Ca(OH)2=CaCO3↓+H2O、CO2+H2O+CaCO3=Ca(HCO3)2,即2CO2+Ca(OH)2=Ca(HCO3)2,则吸收的二氧化碳为0.01mol,剩余二氧化碳的物质的量为:0.1mol-0.01mol=0.09mol,0.09mol二氧化碳全部进入D装置且被吸收,D中n(NaOH)=cV=1mol/L×0.1L=0.1mol,由方程式可得:
CO2 + 2NaOH = Na2CO3 +H2O
0.05mol 0.1mol 0.05mol
CO2 + H2O + Na2CO3 = 2NaHCO3
(0.09mol-0.05mol) 0.04mol 0.08mol
所以D中溶质及对应的物质的量是0.01molNa2CO3和0.08molNaHCO3,故答案为:0.01molNa2CO3和0.08molNaHCO3。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】下列对一些实验事实的理论解释正确的是( )
选项 | 实验事实 | 理论解释 |
A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
B | CO2为直线形分子 | CO2分子中 |
C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成:

(1)福酚美克中的含氧官能团有_______和_______(填名称)。
(2)C→D的转化属于_______反应(填反应类型)。
(3)上述流程中设计A→B步骤的目的是_________________________________。
(4)A与足量氢氧化钠溶液反应的方程式为:_________________________________。
(5)A的同分异构体X满足下列条件:
Ⅰ.能与NaHCO3反应放出气体;
Ⅱ.能与FeCl3溶液发生显色反应。
符合上述条件的同分异构体有______种。其中核磁共振氢谱有5组吸收峰的结构简式为______________。
(6)参照上述合成路线和信息,以乙醛为原料(无机试剂任选),设计制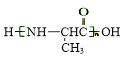 的合成路线:____________________________。
的合成路线:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Mg、Al各1mol分别与50mL2mol/L的硫酸溶液反应,下列说法正确的是( )
A.镁铝产生的氢气一样多
B.钠放出氢气最多
C.铝最终产生氢气最多
D.产生氢气的量无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
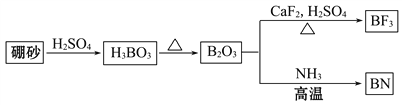
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是________________________、__________________________。
(2)基态B原子的电子排布式为________,B和N相比,电负性较大的是________,BN中B元素的化合价为________。
(3)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为________。
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a. 体积②>③>①>④ b. 密度②>③>④>①
c. 质量②>③>①>④ d. 氢原子个数①>③>④>②
A. abc B. bcd C. abd D. abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_______________________,其基态原子的价层电子排布图为__________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_________(填标号)。

(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是___________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为______。
(5)某R的氧化物晶胞结构如下图所示,该物质的化学式为____________。已知该晶体密度为ρg/cm3,距离最近的两个原子的距离为d pm,则R的相对原子质量为___________________。 (阿伏加德罗常数为NA)

(6)X形成的一种常见单质,性质硬而脆,原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯分子中C—C之间形成一个σ键和一个π键;乙炔分子C—C之间形成一个σ键和2个π键。根据所学理论,写出:
(1)在乙烯和乙炔分子与溴发生加成反应中,断裂何种类型键?____________
(2)写出加成反应方程式。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24Cr原子处于基态时,价电子排布可用电子排布图表示成![]() ,而不是
,而不是![]() 。下列说法中,正确的是()
。下列说法中,正确的是()
A. 这两种排布方式都符合能量最低原理
B. 这两种排布方式都符合泡利原理
C. 这两种排布方式都符合洪特规则
D. 这个实例说明洪特规则有时候和能量最低原理是矛盾的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com