
 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.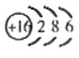 .
.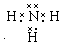 (或
(或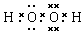 ,
,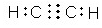 ).
). NH4++OH-.
NH4++OH-.分析 从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)g为S,原子核外有3个电子层,最外层电子数为6;
(2)离子核外电子层数越多,离子半径一般越大非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
(3)组成一种四原子共价化合物可为氨气、过氧化氢、乙炔等;
(4)1mol钠在氧气种燃烧生成过氧化钠,热化学方程式为2Na(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-255.5 kJ/mol-1;
(5)①氨气可与水反应生成一水合氨,且可与水分子间形成氢键,易溶于水;
②一水合氨为弱碱,可电离出氢氧根离子,溶液呈碱性;
③氨水中存在NH3.H2O NH4++OH-,如使平衡逆向移动,可增大NH4+或OH-浓度.
NH4++OH-,如使平衡逆向移动,可增大NH4+或OH-浓度.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)g为S,原子核外有3个电子层,最外层电子数为6,原子结构示意图为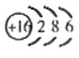 ,故答案为:
,故答案为: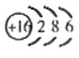 ;
;
(2)离子核外电子层数越多,离子半径一般越大,则有Cl->Na+,非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,即HClO4>H2SO4,
故答案为:Cl->Na+,HClO4>H2SO4;
(3)组成一种四原子共价化合物可为氨气、过氧化氢、乙炔等,电子式为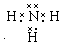 ( 或
( 或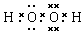 ,
,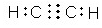 ),
),
故答案为: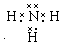 ( 或
( 或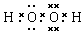 ,
,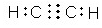 );
);
(4)1mol钠在氧气种燃烧生成过氧化钠,热化学方程式为2Na(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-255.5 kJ/mol-1,
故答案为:2Na(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-255.5 kJ/mol-1;
(5)①氨气可与水反应生成一水合氨,且可与水分子间形成氢键,易溶于水,
故答案为:NH3与H2O能形成分子间氢气键、NH3与H2O能发生反应;
②一水合氨为弱碱,可电离出氢氧根离子,溶液呈碱性,电离方程式为NH3.H2O NH4++OH-,故答案为:NH3.H2O
NH4++OH-,故答案为:NH3.H2O NH4++OH-;
NH4++OH-;
③氨水中存在NH3.H2O NH4++OH-,如使平衡逆向移动,可增大NH4+或OH-浓度,加入氯化铵或氢氧化钠等溶液,故答案为:BD.
NH4++OH-,如使平衡逆向移动,可增大NH4+或OH-浓度,加入氯化铵或氢氧化钠等溶液,故答案为:BD.
点评 本题考查结构位置性质关系、离子半径的大小比较、元素周期律、电子式、有机物推断等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:推断题
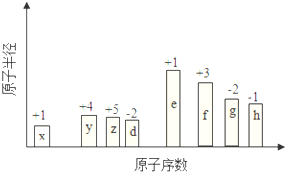 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.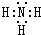 .位于第四周期且与z同主族的元素,其气态氢化物的化学式为AsH3.
.位于第四周期且与z同主族的元素,其气态氢化物的化学式为AsH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H1H2(g)+Cl2(g)=2HCl(g);△H2 | |
| C. | 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 | |
| D. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
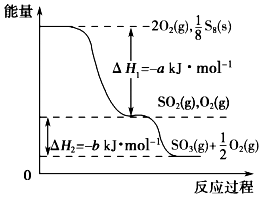 在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )| A. | S8的燃烧热△H=-a kJ•mol-1 | |
| B. | 1 mol SO2和过量 O2反应可释放出 b kJ 的热量 | |
| C. | 已知1个S8分子中有8个S-S,S=O的键能为d kJ•mol-1,O=O的键能为e kJ•mol-1,则S8分子中S-S的键能为(2d-a-e) kJ•mol-1 | |
| D. | 若使用V2O5作催化剂,当SO2(g)转化生成1mol SO3(g)时,释放的热量小于b kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物:CO2、NO、SO2、H2O | B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | ||
| C. | 铵盐:NH4Cl、NH4NO3、NH3•H2O | D. | 碱性氧化物:Na2O、CaO、CO2、Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{14}$ mol-1 | B. | $\frac{a}{28}$ mol-1 | C. | 14a mol-1 | D. | 28a mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的质量分数增加 | B. | 平衡不移动 | ||
| C. | 化学计量数:m+n=3 | D. | 物质C的体积分数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com