
| A. | A的质量分数增加 | B. | 平衡不移动 | ||
| C. | 化学计量数:m+n=3 | D. | 物质C的体积分数增大 |
分析 在温度不变的情况下,将容积增大一倍,如平衡不移动,则c(A)应为0.25mol/L,而达到平衡时c(A)=0.30mol/L,说明平衡向逆反应方向移动,则有m+n>3,此意解答该题.
解答 解:在温度不变的情况下,将容积增大一倍,如平衡不移动,则c(A)应为0.25mol/L,而达到平衡时c(A)=0.30mol/L,说明平衡向逆反应方向移动,则有m+n>3,
A.平衡向逆反应方向移动,A的质量的分数增大,故A正确;
B.由分析可知,平衡向逆反应方向移动,故B错误;
C.由分析可知,m+n>3,故C错误;
D.平衡向逆反应方向移动,物质C的体积分数减小,故D错误.
故选A.
点评 本题考查化学平衡知识,题目难度不大,注意根据增大体积A的浓度变化判断反应进行的方向为解答该题的关键.


科目:高中化学 来源: 题型:解答题
 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.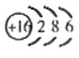 .
.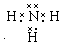 (或
(或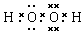 ,
,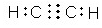 ).
). NH4++OH-.
NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油不能使溴水褪色 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质遇到硫酸铜后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
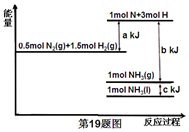
| A. | N2(g)+3H2(g)=2NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=-(a-b)kJ•mol-1 | |
| C. | 2NH3(1)=N2(g)+3H2(g)△H=2(a+b-c)kJ•mol-1 | |
| D. | 2NH3(1)=N2(g)+3H2(g)△H=2(b+c-a)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
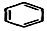 +H2C═CH2$\stackrel{一定条件}{→}$
+H2C═CH2$\stackrel{一定条件}{→}$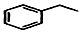
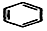 +2H2C═CH2$\stackrel{一定条件}{→}$
+2H2C═CH2$\stackrel{一定条件}{→}$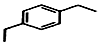
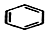 +2H2C═CH2$\stackrel{一定条件}{→}$
+2H2C═CH2$\stackrel{一定条件}{→}$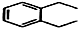
 .
.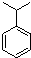 . N:
. N: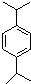 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体属于介稳体系 | |
| B. | 蒸发操作中主要仪器是坩埚 | |
| C. | 粗盐经过溶解、过滤、蒸发后得到的是纯净的食盐 | |
| D. | NH4NO3不属于盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下2.24L O2 | |
| B. | 含NA个氢分子的H2 | |
| C. | 8.5g氨气(氨气的摩尔质量为17g•mol-1) | |
| D. | 含3.01×1022个分子的CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 平衡时的热量变化 | |||||||
| 0 | 20 | 40 | 60 | 80 | 120 | |||
| 第一组 | X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 | 放出Q1kJ |
| 第二组 | X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 | 吸收Q2kJ |
| A. | Q1+Q2=11a(a>0) | |
| B. | k正=K•k逆(K为已知反应的平衡常数,下同) | |
| C. | K=$\frac{0.21{6}^{2}}{0.10{8}^{2}}$ | |
| D. | 相同温度下,在第二组平衡后的混合气体中再加入2molHI,重新达到平衡后,HI的转化率为21.6% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com