
| A. | 胶体属于介稳体系 | |
| B. | 蒸发操作中主要仪器是坩埚 | |
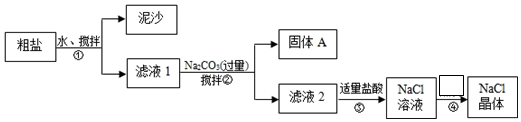
| C. | 粗盐经过溶解、过滤、蒸发后得到的是纯净的食盐 | |
| D. | NH4NO3不属于盐 |
分析 A.胶体的稳定性介于溶液与浊液之间,可发生聚沉;
B.在蒸发皿中进行蒸发操作;
C.粗盐经过溶解、过滤、蒸发后,只除去泥沙等不溶性杂质;
D.NH4NO3为铵根离子与硝酸根离子构成的盐.
解答 解:A.胶体的稳定性介于溶液与浊液之间,可发生聚沉,则胶体属于介稳体系,故A正确;
B.在蒸发皿中进行蒸发操作,而坩埚可用于结晶水的测定及物质加热分解实验,故B错误;
C.粗盐经过溶解、过滤、蒸发后,只除去泥沙等不溶性杂质,不能除去可溶性杂质,故C错误;
D.NH4NO3为铵根离子与硝酸根离子构成的盐,属于铵盐,故D错误;
故选A.
点评 本题考查较综合,涉及物质分类、混合物分离提纯,为高频考点,把握物质的组成、分类、性质及混合物分离提纯实验为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氧化物:CO2、NO、SO2、H2O | B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | ||
| C. | 铵盐:NH4Cl、NH4NO3、NH3•H2O | D. | 碱性氧化物:Na2O、CaO、CO2、Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
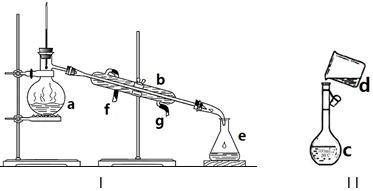
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的质量分数增加 | B. | 平衡不移动 | ||
| C. | 化学计量数:m+n=3 | D. | 物质C的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在铁制的炒锅、蒸锅等炊具上镀铜、防止生锈 | |
| B. | 地下钢铁管道连接镁块来防止钢铁锈蚀 | |
| C. | 健身器材刷油漆以防锈 | |
| D. | 洗衣机的滚筒采用不锈钢材料、既耐磨又耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH2PO4、Na2HPO4 | B. | Na2CO3、NaHCO3 | C. | NaHSO4、NaHCO3 | D. | Na2SO4、CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.36×10-5 mol•L-1 | B. | 8.90×10-6 mol•L-1 | ||
| C. | 4.45×10-2 mol•L-1 | D. | 1×10-5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
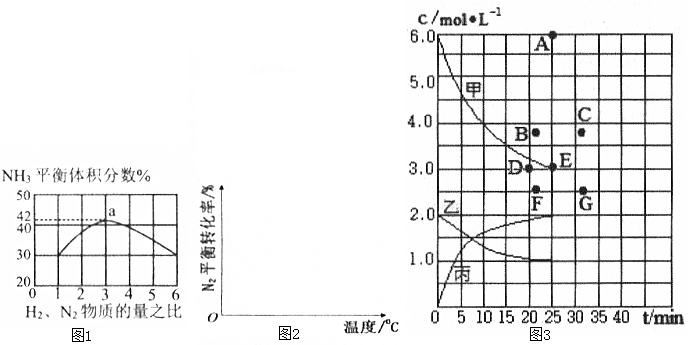

| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| N(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| N(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com