
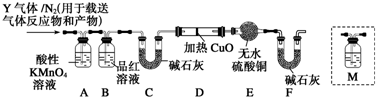
分析 (1)常温下,铁遇冷的浓硫酸发生钝化现象;
(2)①亚铁离子有还原性,能还原酸性高锰酸钾溶液而使其褪色;
②根据硫酸钡与二氧化硫的关系式计算二氧化硫的体积,再根据体积分数公式计算;
(3)二氧化硫能使品红溶液褪色,据此判断是否含有二氧化硫;
(4)碳素钢中含有碳,加热条件下,碳和浓硫酸反应生成二氧化碳;
(5)用澄清石灰水检验二氧化碳,首先要排除二氧化硫的干扰;
(6)Q1在标准状况下,密度为0.089 3g•L-1.摩尔质量M=0.089g/L×22.4L/mol=2g/mol,所以Q1是氢气,氢气具有还原性,能含有氧化铜同时生成水,水能使无水硫酸铜变蓝.
解答 解:(1)常温下,铁遇冷的浓硫酸发生氧化还原反应,在铁表面生成一层致密的氧化物薄膜而阻止了进一步的反应,即发生钝化现象,所以反应片刻后取出观察,铁钉表面无明显变化,
故答案为:常温下,铁遇浓硫酸发生钝化现象;
(2)①亚铁离子具有还原性,而酸性高锰酸钾有氧化性,发生氧化还原反应使高锰酸钾溶液褪色,铁离子和亚铁离子同时存在时,应该用酸性高锰酸钾溶液检验亚铁离子,故D正确,
故答案为:D;
②SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,
所以硫酸钡和二氧化硫之间的关系式为SO2~BaSO4,设二氧化硫的体积为V,
SO2~BaSO4,
22.4L 233g
V 4.66g
则:V=$\frac{22.4L×4.66g}{233g}$=0.448L,
所以二氧化硫的体积分数为:$\frac{0.448L}{0.56L}$×100%=80%,
故答案为:80%;
(3)二氧化硫能使品红溶液褪色,所以用品红溶液检验二氧化硫是否除尽,
故答案为:检验SO2是否除尽;
(4)碳素钢中含有碳,加热条件下,碳能和浓硫酸反应生成二氧化硫、二氧化碳和水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(5)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,但二氧化硫还能使品红溶液褪色,所以要检验二氧化碳必须排除二氧化硫的干扰,B装置是检验二氧化硫是否除尽,所以澄清石灰水应放置在B和C之间,即在通入碱石灰之前检验,
故答案为:C;
(6)Q1在标准状况下,密度为0.089 3g•L-1.摩尔质量M=0.0893g/L×22.4L/mol=2g/mol,所以Q1是氢气,氢气具有还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色,这是检验水的特征反应,所以如果D中氧化铜变红,E中无水硫酸铜变蓝,则证明含有氢气,
故答案为:D中固体由黑色变红色和E中固体由白色变蓝色;
点评 本题考查性质实验方案的设计与评价,题目难度中等,涉及浓硫酸的性质、二氧化硫的性质、常见物质的检验等知识点,侧重于考查学生综合运用化学知识的能力和实验能力,注意常温下铁和冷的浓硫酸不是不反应,而是反应生成了致密的氧化物薄膜而阻止了进一步反应,为易错点.


科目:高中化学 来源: 题型:解答题

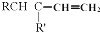
 +
+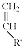 $\stackrel{△}{→}$
$\stackrel{△}{→}$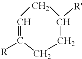
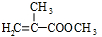 .
.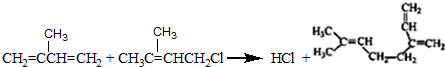 .
.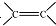 和
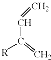
和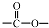 结构的D的所有同分异构共有9种(含顺反异构体),写出其中任意一种含反式结构的结构简式
结构的D的所有同分异构共有9种(含顺反异构体),写出其中任意一种含反式结构的结构简式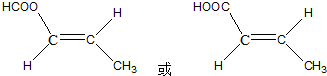 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 用系统命名法命名该烃:2,3-二甲基戊烷.
用系统命名法命名该烃:2,3-二甲基戊烷.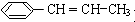 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O | |
| B. | 充电时,当阳极质量增加23.9 g时,溶液中有0.2 mol电子通过 | |
| C. | 放电时,正极区pH增大 | |
| D. | 充电时,Pb电极与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气的首要污染物包括CO2、SO2、NO、NO2、O3等 | |
| B. | PM2.5指的是直径为2.5微米的可吸入颗粒物,因其直径小、比表面积大、活性强、易吸附有毒有害的物质,对人的健康和大气环境质量的影响较大 | |
| C. | 光化学烟雾的形成与氮氧化物有关 | |
| D. | SO2的治理技术和设备有:原煤脱硫技术、改进燃烧技术和烟气脱硫设备等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素的葡萄糖单元中含有羟基 | |
| B. | 氨基酸分子中既有氨基,又有羧基,属于两性化合物 | |
| C. | CH3CO18OH和C2H5OH发生酯化反应的有机产物是CH3CO18OC2H5 | |
| D. | 用甘氨酸(H2N-CH2-COOH)和丙氨酸(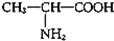 )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
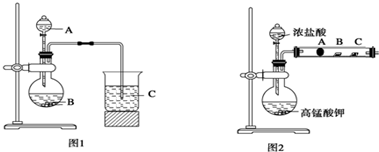
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
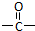 ”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.
”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.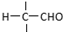 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$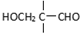
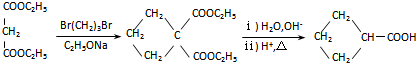
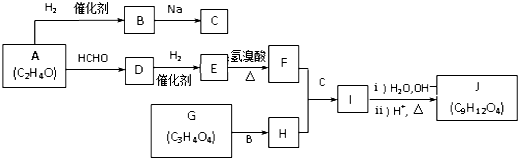
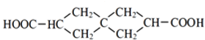 .J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.写出符合上述所有条件的X的一种结构简式
.J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.写出符合上述所有条件的X的一种结构简式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com