
【题目】煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
(1)已知:①C(s)+H2O(g)═CO(g)+H2(g) △H=+131.3kJ·mol-1
②CO2(g)+H2(g)═CO(g)+H2O(g) △H=+41.3kJ·mol-1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为。该反应在(填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①10~20min内,N2的平均反应速率v(N2)=。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是填字母序号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g) ![]() H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol·L-1 , 在该条件下达到平衡时,CO的转化率为。
【答案】
(1)C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+90KJ·mol-1;高温
(2)0.009 mol·L-1;AD
(3)75%
【解析】(1)根据盖斯定律:①-②即得到C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH=+90.0 kJ·mol-1。该反应是吸热的体积增加的可逆反应,则根据ΔG=ΔH-T·ΔS可知反应在高温下自发进行。
(2)①根据图表信息,10~20min内氮气的浓度变化为(0.25-0.16)mol/L=0.09mol/L,N2的平均反应速率v(N2)=0.09mol/L÷10min=0.009mol/(L·min)或0.00015 mol/(L·S);②30min后,只改变某一条件,反应重新达到平衡,各物质的浓度同等程度的增大,但平衡不移动,由于该反应是反应前后气体体积不变的反应,所以是改变压强所致,因此改变的条件可能是A、通入一定量的NO或D、适当缩小容器的体积;而B项中活性炭是固体,加入一定量的活性炭,各物质的浓度不会增大,C项中加入合适的催化剂只能加快化学反应速率,各物质的浓度不会增大,答案选AD。
(3)
CO(g)+ | H2O(g) | H2(g)+ | CO2(g) | |
起始(mol/L) | 0.020 | 0.020 | 0 | 0 |
转化(mol/L) | n | n | n | n |
平衡(mol/L) | 0.020-n | 0.020-n | n | n |
则(n×n)÷(0.020-n)×(0.020-n)=K=9 ,解得n=0.015,该条件下达到平衡时,CO的转化率为(0.015/0.020)×100%=75%。
【考点精析】根据题目的已知条件,利用化学平衡状态的判断的相关知识可以得到问题的答案,需要掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是
A.氧化还原反应的本质是元素化合价发生变化
B.物质所含元素化合价降低的反应是氧化反应
C.置换反应一定属于氧化还原反应
D.化合反应和分解反应不可能是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题,回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是 ___________________(填字母)。
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热量很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
(2)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,则乙醇燃烧的热化学方程式为____________________________________________________________。
(3)由于C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJmol1(b>0)的反应中,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________(填“放出”或“吸收”)能量才能转化为生成物。
(4)关于用水制取二次能源氢气,以下研究方向不正确的是________________
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
(5)已知下列两个热化学方程式:
A、2H2(g)+O2(g) ===2H2O(l) △H=-571.6 kJmol-1 B、C3H8(g)+5O2(g) ===3CO2(g)+4 H2O(l) △H=-2 220 kJmol-1,其中,能表示燃烧热的热化学方程式为___________(A或B),其燃烧热为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下图所示,下列说法不正确的是
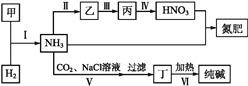
A. 甲、乙、丙三种物质中都含有氮元素
B. 反应Ⅰ、Ⅱ、Ⅲ中含氮元素的反应物都被氧化
C. Ⅴ中发生反应:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
D. Ⅵ利用丁物质受热易分解的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
(1)Ⅰ.将NaOH溶液与NH4Cl溶液混合生成NH3·H2O ,从而验证NaOH的碱性大于NH3·H2O继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: 。
(2)Ⅱ.利用下图装置可以验证非金属性的变化规律。干燥管D的作用是。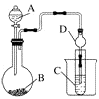
实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2 , 请选择合适药品设计实验验证氯的非金属性大于硫:烧瓶中发生反应的离子方程式为。
装置C中的实验现象为有淡黄色沉淀生成,离子方程式为。
(3)若要用此装置证明酸性:H2CO3>H2SiO3进而证明非金属性:C>Si,则A中加观察到C中溶液的现象为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某反应达到平衡,其平衡常数为K= ![]() 恒容时,升高温度,混合气体的颜色加深,下列说法正确的是( )
恒容时,升高温度,混合气体的颜色加深,下列说法正确的是( )
A.该反应的化学方程式为:NO2+CO═CO2+NO
B.该反应的焓变为负值
C.升高温度,正反应速率减小
D.恒温时,增大压强,颜色加深,因平衡左移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com