
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出金属元素A的原子结构示意图:。
(2)写出下列反应的离子方程式:
反应③;反应⑤
(3)检验物质G中阳离子的操作方法。
(4)实验室制取黄绿色气体乙的化学方程式为 , 在该反应中如有0.5 mol乙生成,转移的电子的物质的量是mol。制取完毕,多余的乙将用D的水溶液来吸收,其离子方程式为。
【答案】
(1)
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑;2Fe2++Cl2=2Fe3++2Cl-
(3)物质G少许于试管中,向其中滴加少量的KSCN溶液,溶液变为血红色(或红色),证明物质G中有Fe3+离子。
(4)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;1;Cl2+2OH=Cl-+ClO-+H2O
MnCl2+Cl2↑+2H2O;1;Cl2+2OH=Cl-+ClO-+H2O
【解析】(1)金属元素Na的核电荷数11,其原子结构示意图为 ![]() ;
;
(2)反应③是金属Al溶解于NaOH溶液生成氢气,发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;反应⑤是在氯化亚铁溶液中通氯气,将Fe2+氧化为Fe3+ , 发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(3)检验FeCl3溶液中Fe3+的方法是取FeCl3少许于试管中,向其中滴加少量的KSCN溶液,溶液变为血红色(或红色),证明FeCl3中有Fe3+离子;
(4)实验室用二氧化锰和浓盐酸混合加热制取氯气,发生反应的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,在该反应中如有0.5 mol氯气生成,转移的电子的物质的量是1mol。制取完毕,多余的Cl2对环境有污染,需用NaOH的水溶液来吸收,其离子方程式为 Cl2+2OH=Cl+ClO+H2O。
MnCl2+Cl2↑+2H2O,在该反应中如有0.5 mol氯气生成,转移的电子的物质的量是1mol。制取完毕,多余的Cl2对环境有污染,需用NaOH的水溶液来吸收,其离子方程式为 Cl2+2OH=Cl+ClO+H2O。
故答案为:(1) ;(2)2Al+2OH-+2H2O=2AlO2-+3H2↑;2Fe2++Cl2=2Fe3++2Cl-;(3)物质G少许于试管中,向其中滴加少量的KSCN溶液,溶液变为血红色(或红色),证明物质G中有Fe3+离子。(4)MnO2+4HCl(浓)
;(2)2Al+2OH-+2H2O=2AlO2-+3H2↑;2Fe2++Cl2=2Fe3++2Cl-;(3)物质G少许于试管中,向其中滴加少量的KSCN溶液,溶液变为血红色(或红色),证明物质G中有Fe3+离子。(4)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;1;Cl2+2OH=Cl+ClO+H2O
MnCl2+Cl2↑+2H2O;1;Cl2+2OH=Cl+ClO+H2O
金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2 , 与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)3 , 故物质G中含有Fe3+ , E与金属C反应生成F,F与氯气反应生成G,可推知C为Fe,F为FeCl2 , G为FeCl3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以下每个选项中的两组物质都能反应,且放出同一种气体产物的是( )
A.铜与稀硫酸,铜与浓硫酸
B.铁与稀硫酸,铁与浓硫酸
C.硫化钠与稀硫酸,亚硫酸钠与稀硫酸
D.硫化钠与稀硫酸,硫化钠与稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列反应:2SO2+O2![]() 2SO3 , 如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为mol/L.min , 用O2浓度变化来表示的反应速率为mol/L.min . 如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(Lmin),那么2min时SO2的浓度为mol/L .
2SO3 , 如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为mol/L.min , 用O2浓度变化来表示的反应速率为mol/L.min . 如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(Lmin),那么2min时SO2的浓度为mol/L .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置中能达到实验目的是( ) 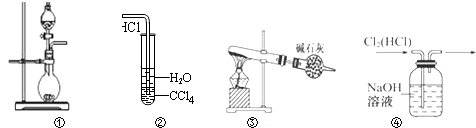
A.图①可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
B.装置②可用于氯化氢气体溶于水
C.以NH4Cl为原料,装置③可用于实验室制备少量干燥的NH3
D.装置④可用于除去Cl2中的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是重要化学物质,某学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其流程如图: 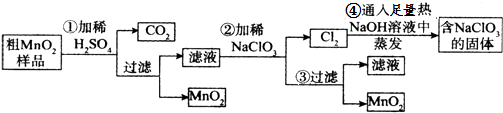
按要求回答下列问题
(1)第②步操作中,氧化性强弱顺序:ClO3﹣MnO2 (填“>”“<”),写出操作②中发生反应的离子方程式;当反应中转移2mol电子时,生成的氧化产物的物质的量为mol.
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的 .
a.NaCl b.NaClO c.NaClO4 d.NaOH
(3)为得到纯净的MnO2 , 须将过滤后的MnO2合并后进行洗涤,判断是否洗涤干净可选用的试剂是(填写一组即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s) cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )

A.升高温度,平衡向正反应方向移动
B.使用催化剂,C的物质的量分数增加
C.化学方程式系数a<c+d
D.根据图象无法确定改变温度后平衡移动方向
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com