
����Ŀ��MnO2����Ҫ��ѧ���ʣ�ijѧϰС������˽���MnO2�����н϶��MnO��MnCO3��Fe2O3����Ʒת��Ϊ��MnO2ʵ�飬��������ͼ�� 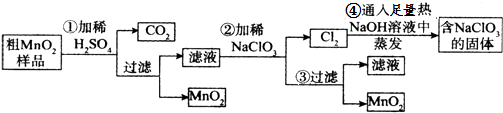
��Ҫ��ش���������
��1���ڢڲ������У�������ǿ��˳��ClO3��MnO2 �����������������д���������з�����Ӧ�����ӷ���ʽ������Ӧ��ת��2mol����ʱ�����ɵ�������������ʵ���Ϊmol��
��2���ڢܲ������У����յõ��Ĺ����NaClO3�⣬��һ���������������е� ��
a��NaCl b��NaClO c��NaClO4 d��NaOH
��3��Ϊ�õ�������MnO2 �� �뽫���˺��MnO2�ϲ������ϴ�ӣ��ж��Ƿ�ϴ�Ӹɾ���ѡ�õ��Լ�������дһ�鼴�ɣ���
���𰸡�
��1������Mn2+��2e��+2H2O=MnO2+4H+��1
��2��ad
��3��BaCl2
���������⣺��MnO2�����н϶��MnO��MnCO3��Fe2O3����Ʒ�м��������ϡ���ᣬ����MnO2���������ᣬ����Ʒ�е�MnO��MnCO3�ֱ�����ᷴӦ���ɿ����Ե�MnSO4 �� ���˵���ҺΪ��������Һ������NaClO3������ӦΪ��5Mn2++2ClO3��+4H2O=5MnO2+Cl2��+8H+ �� �ٹ��˵õ���Һ�Ͷ������̹��壬���������ȵ��������Ʒ�Ӧ���������Ʒ���ʽΪ��3Cl2+6NaOH=NaClO3+NaCl+3H2O.
��1.����֪5Mn2++2ClO3��+4H2O=5MnO2+Cl2��+8H+ �� ClO3������������MnO2����������������ԣ�ClO3����MnO2����NaClO3ת��2mol����ʱ������NaClO3Ϊ0.4mol����������������MnO2Ϊ1mol��NaClO3�ڳ����������ᷴӦ�����������䷴Ӧ�����ӷ���ʽΪ��ClO3��+5Cl��+6H+=3Cl2��+3H2O��
���Դ��ǣ�����ClO3��+5Cl��+6H+=3Cl2��+3H2O��1��
��2.���ڢܲ�������NaOH�����������ķ�ӦΪ��3Cl2+6NaOH=NaClO3+NaCl+3H2O�������յõ��Ĺ����NaClO3�⣬����NaOH��NaCl�����Դ��ǣ�ad��
��3.��������û��ϴ�Ӹɾ�������Һ�к�����������ӣ��������������ѡ���Ȼ�����Һ�����Դ��ǣ�BaCl2 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.Ϊ����������ʹ��ŨH2SO4ʱҪע�ⰲȫ������ŨH2SO4��������������ͼ��ʶ
B.ʵ���ҿ�ͨ������ķ�����ȥ����ˮ�к��е�Cl��������������ˮ
C.����ɫ��Ӧʵ��ʱ��Ӧ�Ƚ���˿(����˿)��ϡ����ϴ�����ھƾ���������������û����ɫʱ����պȡ������Һ����ʵ��
D.���ڼ�������ʻ�ѧ���ʻ��ã�ʵ�����еĸ��ּ�������ʾ�������ú����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�������A��B��C������ס��ҡ���������D��E��F��G��H������֮���ܷ������·�Ӧ��ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ���������
�����������Ϣ�ش��������⣺
��1��д������Ԫ��A��ԭ�ӽṹʾ��ͼ����
��2��д�����з�Ӧ�����ӷ���ʽ��
��Ӧ������Ӧ��
��3����������G�������ӵIJ���������
��4��ʵ������ȡ����ɫ�����ҵĻ�ѧ����ʽΪ �� �ڸ÷�Ӧ������0.5 mol�����ɣ�ת�Ƶĵ��ӵ����ʵ�����mol����ȡ��ϣ�������ҽ���D��ˮ��Һ�����գ������ӷ���ʽΪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������(����)
A.![]() ��
�� ![]() ��H����H2����Ԫ�ص����ֲ�ͬ����
��H����H2����Ԫ�ص����ֲ�ͬ����
B.![]() ��
�� ![]() ��ʯī�ͽ��ʯ��Ϊͬ��������
��ʯī�ͽ��ʯ��Ϊͬ��������
C.1H �� 2H �Dz�ͬ�ĺ���
D.12C��14C��Ϊͬλ�أ��������ʲ�ͬ������ѧ���ʼ�����ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β����NO�����ķ�ӦΪ��N2��g��+O2��g��2NO��g����һ�������£������ʵ�����N2��g����O2��g���ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ������� 
A.�¶�T�£��÷�Ӧ��ƽ�ⳣ�� ![]()
B.�¶�T�£����ŷ�Ӧ�Ľ��У����������ܶȼ�С
C.����b��Ӧ�������ı�����Ǽ����˴���
D.������b��Ӧ�������ı����¶ȣ����жϸ÷�Ӧ�ġ�H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������붬���������дֵ����������أ�����Ӱ�����ǵ��ճ�������д�ʩ�Կ���������Ӱ����ǣ� ��
A. ����������ʻ�������˹�������B. ������ũ����ո�
C. �ֲ�����ʵ���˹����ꡢ��ѩD. ��ͥ��װ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��г��豸���ԣ��� 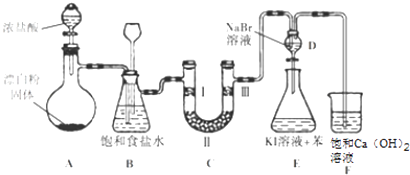
��1��װ��A�������ķ���װ�ã�����ʢ��Ũ��������������� �� ��д���÷�Ӧ��Ӧ�����ӷ���ʽ�� ��
��2��װ��B�б���ʳ��ˮ����������ͬʱװ��BҲ�ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������д����������ʱB�е����� ��
��3��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C�Т����η������ʵ����Ӧ��������ĸ��ţ���
��� | �� | �� | �� |
a | �������ɫ���� | ��ʯ�� | ʪ�����ɫ���� |
b | �������ɫ���� | ��ˮ����ͭ | ʪ�����ɫ���� |
c | ʪ�����ɫ���� | Ũ���� | �������ɫ���� |
d | ʪ�����ɫ���� | ��ˮ�Ȼ��� | �������ɫ���� |
��4�����װ��D��E��Ŀ���DZȽ��ȡ��塢�ⵥ�ʵ������ԣ���Ӧһ��ʱ���������װ��D��������Һ����װ��E�У����۲쵽�������� �� ����������ܡ����ܡ���˵���嵥�ʵ�������ǿ�ڵ⣬ԭ�������ñ�Ҫ�����ֺ����ӷ���ʽ�ش𣩣�
��5����װ����Ҫ�Ľ�֮���ǣ�ԭ���ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�1molX��nmol Y���ݻ�Ϊ2L���ܱ������з������·��ɣ�X��g��+Y��g�� 2Z��g��+M��s����5min��ﵽƽ�⣬��ʱ����2amolZ������˵����ȷ���ǣ�������
A.������ѹ��ʱ�����淴Ӧ���ʾ�����
B.5 min��ƽ����Ӧ����v��X��=0.2amol/��Lmin��
C.��ƽ������ϵ�м���lmolM��s����ƽ�����淴Ӧ�����ƶ�
D.�����������������ٷ����仯ʱ��˵����Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯��ͼ��ʾ��
��֪W��һ�ֺ��ص�������Ϊ18��������Ϊ10��X��Neԭ�ӵĺ�����������1��Y�ĵ�����һ�ֳ����İ뵼����ϣ�Z�ķǽ�������ͬ����Ԫ������ǿ������˵������ȷ����(����)
A.��Ӧ�����Ӱ뾶��X<W
B.��Ӧ����̬�⻯����ȶ��ԣ�Y<Z
C.��ZԪ��ͬ�����Ԫ�����̬��Ϊ��7
D.Y������������X������������Ӧ��ˮ���ﷴӦ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com