B
分析:A.由N=nN
A可知,物质的量相等所含分子数目相等,但N
2和CO的物质的量不一定是1mol;
B.根据n=

计算1.7gH
2O
2的物质的量,每个H
2O
2分子含有18个电子,据此计算电子物质的量,再根据N=nN
A计算电子数目;
C.根据n=cV计算NH
4NO
3的物质的量,1molNH
4NO
3含有2molN原子,据此计算电子物质的量,再根据N=nN
A计算电子数目;
D.常温常压下,气体摩尔体积不是22.4L/mol,大于22.4L/mol.
解答:A.由N=nN
A可知,物质的量相等所含分子数目相等,但N
2和CO的物质的量不一定是1mol,故A错误;
B.1.7gH
2O
2的物质的量为
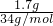
=0.05mol,每个H
2O
2分子含有18个电子,电子物质的量为0.05mol×18=0.9mol,故含有电子数目为0.9mol×N
Amol
-1=0.9N
A,故B正确;
C.NH
4NO
3的物质的量为1L×0.1mol?L
-1=0.1mol,1molNH
4NO
3含有2molN原子,氮原子物质的量为0.1mol×2=0.2mol,故含有氮原子数目为0.2mol×N
Amol
-1=0.2N
A,故C错误;
D.由pV=nRT可知,常温常压下,气体摩尔体积大于22.4L/mol,0.5 N
A个一氧化碳分子物质的量为0.5mol,故一氧化碳的体积大于0.5mol×22.4L/mol=11.2L,故D错误;
故选B.
点评:本题考查常用化学计量的有关计算,难度不大,注意气体摩尔体积的使用条件与现象.

 计算1.7gH2O2的物质的量,每个H2O2分子含有18个电子,据此计算电子物质的量,再根据N=nNA计算电子数目;
计算1.7gH2O2的物质的量,每个H2O2分子含有18个电子,据此计算电子物质的量,再根据N=nNA计算电子数目;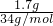 =0.05mol,每个H2O2分子含有18个电子,电子物质的量为0.05mol×18=0.9mol,故含有电子数目为0.9mol×NAmol-1=0.9NA,故B正确;
=0.05mol,每个H2O2分子含有18个电子,电子物质的量为0.05mol×18=0.9mol,故含有电子数目为0.9mol×NAmol-1=0.9NA,故B正确;
