
【题目】(1)Fe2O3+2Al![]() 2Fe+Al2O3 所属基本反应类型是_______________。
2Fe+Al2O3 所属基本反应类型是_______________。
(2)在该反应中_______(填写元素名称)元素的化合价升高,该元素的原子______电子,被________;而_______(填写元素名称)元素的化合价降低,该元素的原子_______电子,被_________。
(3)该反应中,Fe2O3发生了_______反应,Al发生了________反应,_______是氧化剂_________________是还原剂,__________是氧化产物,________是还原产物。
【答案】置换反应 铝 失去 氧化 铁 得到 还原 还原 氧化 Fe2O3 Al Al2O3 Fe
【解析】
Fe2O3+2Al![]() Al2O3+2Fe中,Fe元素的化合价降低,Al元素的化合价升高,结合氧化还原反应基本概念以及置换反应的定义来解答即可。
Al2O3+2Fe中,Fe元素的化合价降低,Al元素的化合价升高,结合氧化还原反应基本概念以及置换反应的定义来解答即可。
(1)此反应为一种单质与一种化合物生成另外一种单质与另一种化合物的反应,因此所属基本反应类型是置换反应;
(2)在该反应中,Al元素的化合价由反应前单质Al的0价变为反应后Al2O3中的+3价,化合价升高,该元素的原子失电子,被氧化,得到的Al2O3是氧化产物;而Fe元素的化合价由反应前Fe2O3中的+3价变为反应后Fe单质的0价,化合价降低,该元素的原子得到电子,被还原,生成的Fe是还原产物;
(3)该反应中,Fe2O3作氧化剂,发生了还原反应,Al作还原剂,Al发生了氧化反应,Al2O3是氧化产物,Fe是还原产物 。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)![]() 2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程(I、Ⅱ)如图所示。下列说法中不正确的是
2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程(I、Ⅱ)如图所示。下列说法中不正确的是

A. t0~t1时,v(正)>v(逆)
B. I、Ⅱ两过程分别达到平衡时,A的体积分数Ⅰ=Ⅱ
C. t2 时刻改变的条件可能是向密闭容器中加A物质
D. Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ=Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
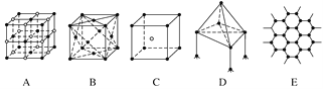
(1)其中代表金刚石的是(填编号字母,下同)____,其中每个碳原子与______个碳原子最接近且距离相等。金刚石属于________晶体。
(2)其中代表NaCl的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(3)代表干冰的是________,它属于________晶体,每个CO2分子与______个CO2分子紧邻。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Cl、Cr、Ni等及其相关化合物用途非常广泛。回答下列问题:
(1)基态铬原子的价电子排布式为______。
(2)与硅原子未成对电子数相同的第四周期元素共有______种;钠与铝处于同周期,铝的熔沸点及硬度均比钠大,其原因是______。
(3)KAlO2在水溶液中实际上都是以K[Al(OH)4]形式存在。其中[Al(OH)4]-配离子,中心原子的杂化类型是____。该K[Al(OH)4]物质中存在的化学键有配位健、_____(填字母代号)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.氢键
(4)CN2称为氰气,其性质与卤素单质相似。与氢氧化钠溶液反应产物之一为NaCN,写出两种与CN-互为等电子体的分子_____,N元素及与其同周期相邻的两种元素第一电离能由大到小的顺序为______。(填元素符号)
(5)氯化铯熔点:645℃,沸点:1290℃;氯化铝熔点:190℃,在180℃时开始升华,造成二者熔、沸点相差较大的原因是______;下图为氯化铯晶胞,已知氯离子半径为anm,铯离子半径为bnm,则氯化铯晶体密度为_____g·cm-3(用a、b和阿伏加德罗常数NA的代数式表式,列出算式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中原子化热、晶格能、键能的单位都是kJmol﹣1

则下列说法正确的是
A. Na(s)与Cl2(g)反应生成1mol NaCl(s)放出的热量为556.1kJ
B. Si(s)+2Cl2(g)═SiCl4(g)△H=﹣602kJmol﹣1
C. 从表中可以看出,氯化钠的熔点比晶体硅高
D. 从表中数据可以看出,微粒半径越大金属键、离子键越弱,而共价键却越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构。其晶体模型如下图所示。请认真观察该晶体模型后回答以下问题:

二氧化硅的晶胞结构
(1)二氧化硅晶体中最小环为________元环。
(2)每个硅原子为________个最小环共有。
(3)每个最小环平均拥有________个硅原子、________个氧原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Na+、Ca2+、NO、CO![]() 、SO
、SO![]() 、Cl-等离子。为了鉴别这些离子,分别取少量溶液进行以下实验:
、Cl-等离子。为了鉴别这些离子,分别取少量溶液进行以下实验:
①加稀盐酸后,生成无色无味的气体,该气体能使澄清石灰水变浑浊。
②加足量的BaCl2产生白色沉淀,过滤,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
③取②中滤液,加硝酸酸化后,再加过量的AgNO3溶液,析出白色沉淀。
(1)上述3个实验证明一定存在的离子是__________,一定不存在的离子是________,可能存在的离子为_______________。
(2)写出①中涉及反应的离子反应方程式: _____________________________。
(3)实验室中常用于检验Na+是否存在的方法叫___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂、基准试剂、还原剂、除氯剂等。
Ⅰ、实验室制备硫代硫酸钠装置图如下。

(1)仪器B的名称是________。
(2)写出装置B制备Na2S2O3的化学反应方程式____________________________。
(3)NaOH溶液的作用是____________________________________。
Ⅱ、测硫代硫酸钠样品纯度步骤如下
①称取Ⅰ中制得硫代硫酸钠样品8.0g配成250mL溶液
②从①中量取20.00mL溶液于锥形瓶中
③用0.lmol·L-1标准碘液滴定,实验测得数据如下
滴定前读数(mL) | 滴定后读数(mL) | 待测液体积(mL) | |
实验一 | 1.20 | 21.00 | 20.00 |
实验二 | 0.40 | 19.20 | 20.00 |
实验三 | 0.50 | x | 20.00 |
(4)该滴定时,向锥形瓶中加入1至2滴淀粉液作指示剂,则达到滴定终点的判断标准是______________。
(5)x读数如图所示,则x=________,根据所测的数据计算该硫代硫酸钠样品纯度为_______________。(已知I2+2Na2S2O3=2NaI+Na2S4O6)

(6)若步骤①中量取20.00mL硫代硫酸钠溶液时,未用硫代硫酸钠溶液润洗滴定管,则测得样品的纯度将______________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验、现象与结论正确且相符的是( )
实验 | 现象 | 结论 | |
A | 向盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液 | 溶液变成棕黄色,一段时间后,溶液中出现气泡,随后有红褐色沉淀生成 | Fe2+催化H2O2分解产生O2;H2O2分解反应放热,促进Fe3+的水解平衡正向移动 |
B | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应: 2NO2 (g) |
C | SO2通入新制氯水 | 溶液褪色 | SO2具有漂白性 |
D | 向2支盛有2mL相同浓度硝酸银溶液的试管中,分别加入2滴相同浓度的NaCl和NaI溶液 | 一支无明显现象,另一支产生黄色沉淀 | 相同条件下,AgI比AgCl的溶解度大 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com