
| 族 周期 |
IA | 0 | |||||||
| 1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
| 2 | ② | ③ | Ne | ||||||
| 3 | ④ | ⑤ | Al | S | ⑥ | ||||
 ,故答案为:
,故答案为: ;
;

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
| A、H+、Cu2+、OH- |
| B、H+、Cl-、CO32- |
| C、Fe3+、Cl-、SO42- |
| D、Na+、Ba2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子是化学反应中的最小粒子 |
| B、物质之间的变化不一定都伴随着能量变化 |
| C、化学能、电能、热能之间可以互相转化 |
| D、生成物的总能量大于反应物的总能量,则反应放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是一些常见的单质和化合物之间的转化关系图,有些反应中的部分物质被略去.常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质.反应①、②均为工业上的重要反应.
如图是一些常见的单质和化合物之间的转化关系图,有些反应中的部分物质被略去.常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质.反应①、②均为工业上的重要反应.查看答案和解析>>
科目:高中化学 来源: 题型:
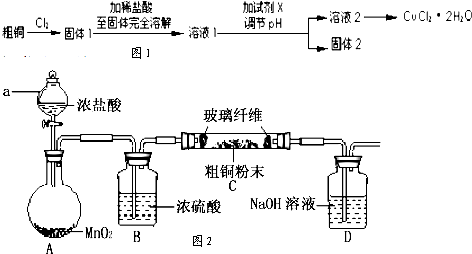
| 离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
2+ 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 名称 | 相对分子质量 | 性状 | 密度(g?mol-1) | 沸点(℃) | 溶解性 | |
| 水 | 乙醚 | |||||
| 2-甲基-2-己醇 | 116 | 无色液体 | 0.8120 | 143 | 微溶 | 溶 |
| 无水乙醚 | 74 | 无色液体 | 0.7138 | 34.5 | 微溶 | - |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com