
【题目】铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝.下列说法不正确的是( )
铝土矿![]() a
a ![]() b
b![]()
![]() c
c![]()
![]() d
d![]() Al.
Al.
A. b中铝元素是以阳离子形式存在
B. ①、②中除加试剂外,还需要进行过滤操作
C. ④进行的操作是加热,而且d一定是氧化铝
D. ③中需要通入过量的二氧化碳
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
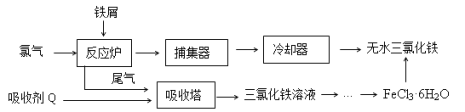
(1)由FeCl3· 6H2O晶体制备无水FeCl3应采取的措施是: 。
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸, 再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000mol·L-1Na2S2O3溶液滴定用去12.50mL。
已知:I2+2S2O32-=2I-+S4O62-
① 写出加入稍过量的KI溶液反应的离子方程式: 。
② 求样品中氯化铁的质量分数(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() (△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
⑴反应的化学方程式中a∶b∶c为;
⑵A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为;
⑶B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是,其值是;
⑷由第一次平衡到第二次平衡,平衡移动的方向是,采取的措施是;
⑸比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低;T2T3(填“<”“>”“=”)判断的理由是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化亚铜(CuⅠ)是阳极射线管覆盖物,不溶于水和乙醇。下图是工业上由冰铜制取无水碘化亚铜的流程。
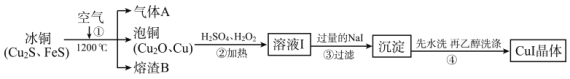
(1)FeS中S的化合价为_____________。
(2)步骤①中Cu2S被转化为Cu,同时有大气污染物A生成,相关化学反应方程式为_____________,熔渣B的主要成分为黑色磁性物质,其化学式为_____________。
(3)步骤②中H2O2的作用是_____________;步骤③中加入过量NaI涉及的主要离子反应方程式为_____________。
(4)步骤④用乙醇洗涤的优点是_____________;检验沉淀是否洗涤干净的方法是_____________。
(5)溶液I中通常含少量Fe(Ⅲ)。已知该工业条件下,Fe(OH)3的Ksp=1.0×10-38,据此分析除去Fe(Ⅲ)(即c(Fe3+)≤1.0×10-5mol/L)应调节pH不小于_____________(水的离子积以常温计)。
(6)准确称取 m g CuI样品,加入足量的Fe2(SO4)3溶液,发生反应为2CuⅠ+4Fe3+===2Cu2++4Fe2++I2,待样品完全反应后,用amol/L酸性KMnO4溶液滴定Fe(Ⅱ),消耗标准液的体积平均值为ⅴmL。样品中CuI的质量分数的计算表达式为_____________;如果滴定前,酸式滴定管没有用标准液润洗,CuI的质量分数_____________(填“偏低”、“偏高”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯为原料合成1,4 —己二醇的路线示意图如下:

(1)有机化合物![]() 中官能团的名称为__________________________________。
中官能团的名称为__________________________________。
(2)反应⑤需要的试剂和条件是_______________;反应类型是_______________________。
(3)有机化合物C的结构简式是_________________________。
(4)写出反应①、③、⑧的化学方程式:① __________________;③ ___________________;
⑧ ________________________。
(5)在反应①~⑧中属于取代反应的有______________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL密度为1.84g/cm3,质量分数为98%的浓硫酸中,c(H2SO4)是( )
A. 18.4 B. 9.8mol·L—1 C. 1.84mol·L—1 D. 18.4mol·L—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是重要的化工原料,工业上可用丙烯加成法生产,主要副产物为3-氯丙烯(CH2=CHCH2C1) ,反应原理为
i.CH2=CHCH,3(g)+Cl2(g)![]() CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
ii.CH2=CHCH,3(g)+Cl2(g)![]() CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
已知:相关化学键的键能数据如下表所示:
化学键 | C=C | C—C | C—Cl | Cl—Cl |
E/( kJ mol-1) | 611 | x | 328 | 243 |
请回答下列问题:
(1)由反应i计算出表中x=_____________。
(2)一定温度下,密闭容器中发生反应i和反应ii,达到平衡后增大压强,CH2C1CHC1CH3的产率______(填“增大”“减小”或“不变”),理由是_________________________________。
(3)T1℃时,向10L恒容的密闭容器中充入1 mol CH2=CHCH2C1和2 mol HC1,只发生反应CH2=CH CH2Cl (g)+HCl(g)![]() CH2ClCHClCH3(g) ΔH3。 5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
CH2ClCHClCH3(g) ΔH3。 5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
①平衡时,HCl的体积分数为_________(保留三位有效数字)。
②保持其它条件不变,6 min时再向该容器中充入0.6 mol CH2=CHCH2Cl、0.2molHC1和0.1mol CH2ClCHClCH3,则起始反应速率 v正(HCl)___ V逆(HCl) (填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com