
【题目】碘化亚铜(CuⅠ)是阳极射线管覆盖物,不溶于水和乙醇。下图是工业上由冰铜制取无水碘化亚铜的流程。
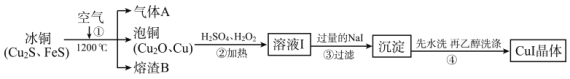
(1)FeS中S的化合价为_____________。
(2)步骤①中Cu2S被转化为Cu,同时有大气污染物A生成,相关化学反应方程式为_____________,熔渣B的主要成分为黑色磁性物质,其化学式为_____________。
(3)步骤②中H2O2的作用是_____________;步骤③中加入过量NaI涉及的主要离子反应方程式为_____________。
(4)步骤④用乙醇洗涤的优点是_____________;检验沉淀是否洗涤干净的方法是_____________。
(5)溶液I中通常含少量Fe(Ⅲ)。已知该工业条件下,Fe(OH)3的Ksp=1.0×10-38,据此分析除去Fe(Ⅲ)(即c(Fe3+)≤1.0×10-5mol/L)应调节pH不小于_____________(水的离子积以常温计)。
(6)准确称取 m g CuI样品,加入足量的Fe2(SO4)3溶液,发生反应为2CuⅠ+4Fe3+===2Cu2++4Fe2++I2,待样品完全反应后,用amol/L酸性KMnO4溶液滴定Fe(Ⅱ),消耗标准液的体积平均值为ⅴmL。样品中CuI的质量分数的计算表达式为_____________;如果滴定前,酸式滴定管没有用标准液润洗,CuI的质量分数_____________(填“偏低”、“偏高”或“无影响”)。
【答案】—2 Cu2S+O2 ![]() 2Cu+SO2 Fe3O4 氧化剂 2Cu2++4I-=2CuI↓+I2 洗去残余水分且乙醇易挥发可快速晾干 蘸取最后一次洗涤液迸行焰色反应,如果火焰无黄色则已洗浄 3
2Cu+SO2 Fe3O4 氧化剂 2Cu2++4I-=2CuI↓+I2 洗去残余水分且乙醇易挥发可快速晾干 蘸取最后一次洗涤液迸行焰色反应,如果火焰无黄色则已洗浄 3 ![]() ×100% 偏高
×100% 偏高
【解析】
由流程图可知,冰铜在1200℃条件下与空气中氧气反应,生成二氧化硫、泡铜(氧化亚铜、铜)和四氧化三铁,泡铜、硫酸和双氧水共热反应生成硫酸铜,硫酸铜溶液与过量NaI溶液反应得到CuI沉淀,CuI沉淀经水洗、乙醇洗涤得到产品。
(1)FeS中Fe元素为+2价,S元素为—2价,故答案为:—2;
(2)步骤①中Cu2S与空气中氧气在1200℃条件下反应生成Cu和二氧化硫,反应的化学方程式为Cu2S+O2 ![]() 2Cu+SO2;由熔渣B的主要成分为黑色磁性物质可知,FeS与空气中氧气在1200℃条件下反应生成四氧化三铁和二氧化硫,故答案为:Cu2S+O2
2Cu+SO2;由熔渣B的主要成分为黑色磁性物质可知,FeS与空气中氧气在1200℃条件下反应生成四氧化三铁和二氧化硫,故答案为:Cu2S+O2 ![]() 2Cu+SO2;Fe3O4;
2Cu+SO2;Fe3O4;
(3)步骤②的反应为在硫酸作用下,H2O2做氧化剂,将氧化亚铜、铜氧化生成硫酸铜;步骤③的反应为硫酸铜溶液与过量NaI溶液反应得到CuI沉淀,反应的离子反应方程式为2Cu2++4I-=2CuI↓+I2,故答案为:氧化剂;2Cu2++4I-=2CuI↓+I2;
(4)步骤④用乙醇洗涤可以洗去固体表面的水,同时由于乙醇易挥发达到快速晾干的目的;洗涤液中含有钠离子、硫酸根离子,可以用焰色反应或酸化的氯化钡溶液检验沉淀是否洗涤干净,故答案为:洗去残余水分且乙醇易挥发可快速晾干;蘸取最后一次洗涤液迸行焰色反应,如果火焰无黄色则已洗浄;
(5)由Ksp=c(Fe3+)c3(OH—)=1.0×10-38可知,当c(Fe3+)≤1.0×10-5mol/L时,c (OH—) ≥1.0×10-11mol/L,则应应调节pH≥3,故答案为:3;
(6)由化学方程式式可得:CuⅠ—2 Fe2+—2/5 MnO4—,则有n(CuⅠ)= 2/5×a×V×10-3mol,m(CuⅠ) = 2/5×a×V×10-3×191g,故CuⅠ%=![]() ×100%;滴定前,酸式滴定管没有用标液润洗,导致消耗的酸性高锰酸钾标准溶液体积偏大,所测CuⅠ%偏大,故答案为:
×100%;滴定前,酸式滴定管没有用标液润洗,导致消耗的酸性高锰酸钾标准溶液体积偏大,所测CuⅠ%偏大,故答案为:![]() ×100%;偏大。
×100%;偏大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于实验基本操作的叙述不正确的是( )
A.使用分液漏斗和容量瓶时,首先要查仪器是否漏液
B.蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体发生暴沸
C.将浓硫酸倒入盛水的量筒中稀释成稀硫酸
D.用蒸发皿进行加热蒸发时,不需垫石棉网可直接进行加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是重要的金属元素,用途极广。
(1)某高效净水剂可由Fe(OH)SO4聚合得到。工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为__________。
(2)已知:①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ/mol
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ/mol
高炉炼铁过程中发生的主要反应为:
1/3Fe2O3(s)+ CO(g) ![]() 2/3Fe(s)+CO2(g) ΔH = a kJ/mol,则a =_____kJ/mol。
2/3Fe(s)+CO2(g) ΔH = a kJ/mol,则a =_____kJ/mol。
已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1115 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,此时v正 ________v逆(填“等于”、“大于”或“小于”)。经过l0 min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v (CO2)= ______________。欲提高上述反应中CO的平衡转化率,可采取的措施是______________;
A.提高反应温度 B.移出部分CO2 C.加入合适的催化剂 D.减小容器的容积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的相对位置如图所示,B的气态氢化物是工业上合成硝酸的重要原料。下列有关说法正确的是
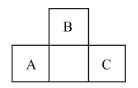
A. B和C两原子间可以形成离子键
B. A的氧化物电子式为![]()
C. 原子半径:A>B>C
D. 最高价氧化物对应的水化物的酸性:B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)称取有机物A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。A分子的质谱图如下图所示:
| (1)有机物A的摩尔质量为______。 |
(2)将此9.0g A在足量纯O2充分燃烧,并使 其产物依次通过无水氯化钙、无水硫酸铜、碱石灰。实验后硫酸铜粉末没有变蓝,称量无水氯化钙增重5.4g,碱石灰增重13.2g。 | (2)经计算,有机物A的分子式为_______。 |
(3)经红外光谱测定,证实其中含有-OH和-COOH两种官能团;经核磁共振氢谱的测定,其核磁共振氢谱图如下图:
| (3)A的结构简式____________________。 |
(4)经红外光谱测定,A的一种同分异构体B中,含有与A相同的官能团。 | (4)A的同分异构体B的结构简式为:____。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝.下列说法不正确的是( )
铝土矿![]() a
a ![]() b
b![]()
![]() c
c![]()
![]() d
d![]() Al.
Al.
A. b中铝元素是以阳离子形式存在
B. ①、②中除加试剂外,还需要进行过滤操作
C. ④进行的操作是加热,而且d一定是氧化铝
D. ③中需要通入过量的二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:

据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是_____.
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
沉淀固体B______;C________;沉淀D_____;溶液E________.
(3)写出①、②、③、④四个反应方程式
①_________________________;
②________________________;
③________________________;
④________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型,请回答下列问题:

(1)向丙中加入溴水,振荡静置后,观察到溶液分层,上层为_______色。
(2)甲的同系物的通式为CnH2n+2,当n=5时,写出含有3个甲基的有机物的结构简式_____。
下图是用乙制备D的基本反应过程

(3)A中官能团为__________。
(4)反应①的反应类型是__________。
(5)写出反应④的化学方程式_______。
(6)现有138gA和90gC发生反应得到80gD。试计算该反应的产率为______(用百分数表示,保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com