
【题目】铁山坪森林公园是重庆主城的肺叶之一,素有“天然氧吧”之称,其原因是森林空
气中富含被称为“空气维生素”的负氧离子,O2-就是其中一种,其摩尔质量为( )
A. 33 B. 32 C. 33g﹒mol-1 D. 32g﹒mol-1
科目:高中化学 来源: 题型:
【题目】用洁净的铂丝蘸取无色溶液,在无色灯焰上观察时看到黄色火焰,则下列有关叙述正确的是( )
A. 用铂丝做焰色反应实验,每次做完后都需要用硫酸洗涤
B. 该溶液一定含有Na+,也可能含有K+
C. 该溶液不含Na+,可能含K+
D. 该溶液可能含Na+或K+中的一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示自然界中的氮循环,相关说法正确的是( )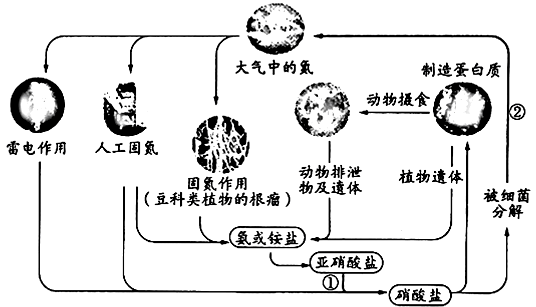
A.“雷电作用”中发生的反应是:N2+ 2O2 ![]() 2NO2
2NO2
B.“人工固氮”过程中,氮元素一定被还原
C.①中涉及的反应可能有:2NO2-+O2 = 2NO3-
D.②中涉及的反应可能有:2NO3-+12H+ = N2+ 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。( )
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是
A.0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B.Fe3+的作用是加快过氧化氢的分解速率
C.反应①是吸热反应、反应②是放热反应
D.反应2H2O2(aq) ![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac. 请回答下列问题:
(1)C,N,O的第一电离能由大到小的顺序为 .
(2)写出基态Cu+的核外电子排布式 .
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为
(4)写出与CO互为等电子体的离子: . (任写一个)
(5)某化合物的晶胞如图所示,写出该化合物的化学式 , 距离每个X+最近的Cl﹣的个数为 . 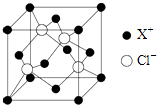
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)+bB(g)mC(s)+nD(g)达到平衡后,保持温度不变,将容器体积减小为原来体积的 ![]() ,达到新的平衡时,D的浓度是原来的1.7倍,下列说法正确的是( )
,达到新的平衡时,D的浓度是原来的1.7倍,下列说法正确的是( )
A.物质B的转化率增大
B.平衡向正反应方向移动
C.物质A的体积分数增大
D.a+b>m+n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2(g)+O2(g)═2H2O(1)△H=﹣285.8kJ/mol
B.2H2(g)+O2(g)═2H2O(1)△H=+571.6kJ/mol
C.2H2(g)+O2(g)═2H2O(g)△H=﹣571.6kJ/mol
D.H2(g)+ ![]() O2(g)═H2O(1)△H=﹣285.8kJ/mol
O2(g)═H2O(1)△H=﹣285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温容器中加入1molN2和3molH2 , 达到平衡时NH3的体积分数为m%.若N2、H2、NH3的起始加入量分别为xmol、ymol、zmol,达到平衡时NH3的体积分数仍为m%.
(1)该容器恒容,则x、y、z应满足的关系是 .
(2)该容器恒压,则x、y、z应满足的关系是 .
(3)设前者达到平衡时生成NH3为amol,则后者达到平衡时生成NH3=mol(用a、x、z表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g)2C(g)+D(s),已知将2molA和1molB
充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中体积分数为n%。
(1)若把2molA和1molB充入该容器时,处于状态Ⅰ,达到平衡时处于状态Ⅱ(如图),则该反应的正反应是 反应。
(2)若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是
(3)若将原容器改为容积可变的容器,在一定温度和常压下,将2molA和1molB充入该容器中,建立平衡之后,B的物质的量浓度为a mol/L.
Ⅰ、现持续增大压强,当:
①当压强为原来1.5倍时,B的平衡时物质的量浓度为m mol/L,测得m<1.5a;
②当压强为原来10倍时,B的平衡时物质的量浓度为n mol/L,测得n>10a;
试解释形成第②种结果的可能原因是
Ⅱ、再将2molA和1molB充入该容器中,则反应速率(Y)与时间(X)关系图象可表示为 
(4)若维持该题原条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol.则D的起始物质的量n(D) 应满足的条件是 (用含有W的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com