
(15分)能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题。
I.已知:Fe2O3(s)+3C(石墨) =2Fe(s)+3CO(g) △H=akJ·mol-1
CO(g)+1/2O2(g)= CO2(g) △H=bkJ·mol-1
C(石墨)+O2(g)=CO2(g) △H=ckJ·mol-1
则反应:4Fe(s)+3O2(g)= 2Fe2O3(s)的焓变△H= kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)= 2H2(g)+O2(g)
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应。
负极: ,
正极: 。
(2)二氧化氯(ClO2)是一种高效安全的自来水消毒剂。ClO2是一种黄绿色气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2为原料制备ClO2流程如下:

已知:电解过程中发生的反应为:
NH4Cl+2HCl NCl3+3H2↑;假设NCl3中氮元素为+3价。
NCl3+3H2↑;假设NCl3中氮元素为+3价。
①写出电解时阴极的电极反应式 。
②在阳极上放电的物质(或离子)是 。
③除去ClO2中的NH3可选用的试剂是 (填序号)
A.生石灰 B.碱石灰 C.浓H2SO4 D.水
④在生产过程中,每生成1mol ClO2,需消耗 mol NCl3。
Ⅰ、6(c-b)-2a(2分);
Ⅱ、(1)D(2分),CH4-8e-+10OH-=CO32-+7H2O(2分);O2+2H2O+4e-=4OH-(2分);
(2)①2H++2e-=H2↑(2分);②NH4Cl(NH4+)(2分);③C(1分);④ mol(2分)。
mol(2分)。
【解析】
试题分析:Ⅰ、①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=akJ•mol-1
②CO(g)+1/2O2(g)=CO2(g)△H=bkJ•mol-1
③C(石墨)+O2(g)=CO2(g)△H=ckJ•mol-1
依据盖斯定律(③-②)×6-①×2得到4Fe(s)+3O2(g)=2Fe2O3(s)△H=6(c-b)-2a kJ•mol-1
Ⅱ、(1)设计成原电池需要是自发进行的氧化还原反应;
A.C(s)+CO2(g)=2CO(g)是非自发进行的氧化还原反应,故A不选;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l),反应是复分解反应,不是氧化还原反应,故B不选;
C.2H2O(l)=2H2(g)+O2(g),反应是非自发进行的氧化还原反应,故C不选;
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l),是自发进行的氧化还原反应,可以设计成原电池;故D选;
D反应是甲烷燃料电池,在碱溶液中甲烷燃料电池中燃料在负极发生氧化反应,氧气在正极得到电子发生还原反应;
负极电极反应为:CH4-8e-+10OH-=CO32-+7H2O;
正极电极反应为:O2+2H2O+4e-=4OH-;
(2)NH4Cl+2HCl NCl3+3H2↑;假设NCl3中氮元素为+3价.
NCl3+3H2↑;假设NCl3中氮元素为+3价.
①电解时阴极上是氢离子得到电子生成氢气,阴极的电极反应式为:2H++2e-=H2↑;
②电解时阳极上是铵根离子失去电子生成氢气,故答案为:NH4Cl(NH4+);
③A、ClO2易溶于水,不能利用碳酸钠溶液吸收氨气,故A错误;
B、碱石灰不能吸收氨气,故B错误;
C、浓硫酸可以吸收氨气,且不影响ClO2,故C正确;
D、ClO2易溶于水,不能利用水吸收氨气,故D错误;
故选:C;
④NCl3与NaClO2恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气,则该反应的离子反应为NCl3+3H2O+6ClO2-=6ClO2↑+3Cl-+3OH-+NH3↑,生产过程中,每生成1mol
ClO2,需消耗 mol,故答案为:
mol,故答案为: mol。
mol。
考点:考查了热化学方程式和盖斯定律的计算应用,原电池、电解池原理的分析判断,和电极反应书写方法,氧化还原反应计算的分析判断。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
(15分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) CH3OH(g) ΔH1
反应II:CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) =2CO2(g) + 4H2O(g) ΔH = -1275.6kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0kJ/mol
③H2O(g) = H2O(l) ΔH= -44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
查看答案和解析>>
科目:高中化学 来源:2010年陕西省高三第四次高考适应性训练(理综)化学部分 题型:填空题
(15分) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
 据判断ΔH1 0 (填“>”、“=”或“<”)。 [来源:学。科。网]
据判断ΔH1 0 (填“>”、“=”或“<”)。 [来源:学。科。网]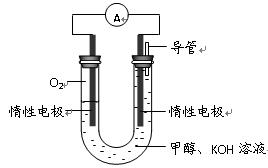
查看答案和解析>>
科目:高中化学 来源:2010年陕西省高三第四次高考适应性训练(理综)化学部分 题型:填空题
(15分) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:
CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
ΔH2
CH3OH(g) + H2O(g)
ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。 [来源:学。科。网]
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
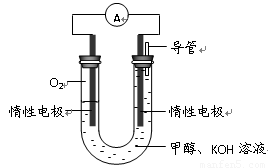
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com