
【题目】常温下,将0.20mol/LH2X溶液与0.20mol/LNaOH溶液等体积混合,所得溶液pH=3.6,继续滴加NaOH溶液至pH=4.0时,溶液中部分粒子浓度(Na+、H2X、HX-、X2-)如下图所示。下列说法错误的是( )

A.图中a代表Na+,d代表H2X分子
B.H2X为二元弱酸,HX-的电离程度大于水解程度
C.混合溶液pH= 3.6时:c(H+)+c(H2X)=c(X2-)+c(OH-)
D.继续滴加NaOH溶液至pH= 7.0时:c(Na+) >c(HX-)+2c(X2-)
【答案】D
【解析】
试题分析:H2X和NaOH等体积混合,反应后产物是NaHX,继续滴加NaOH,pH=4,说明部分NaHX和NaOH反应,反应后溶质为Na2X和NaHX,A、根据量,离子浓度最大的是Na+,pH=4,溶质为Na2X和NaHX,说明HX-发生电离的程度大于X2-水解的程度,因此微粒浓度最小的是H2X,故说法正确;B、根据选项A的分析,故说法正确;C、根据电荷守恒c(Na+)+c(H+)=c(HX-)+2c(X2-)+c(OH-)①,物料守恒可知:c(Na+)=c(HX-)+c(X2-)+C(H2X)②,②代入①得:c(H+)+C(H2X)=C(X2-)+c(OH-),故说法正确;D、根据电荷守恒c(Na+)+c(H+)=c(HX-)+2c(X2-)+c(OH-),继续滴加NaOH溶液至pH=7.0时c(H+)=c(OH-),即:c(Na+)=c(HX-)+2c(X2-),故说法错误。


科目:高中化学 来源: 题型:
【题目】计算题
(1)3.01×1023个OH-含有质子的物质的量是 mol,含有电子的物质的量是 mol;
(2)200mL 2mol/L的Al2(SO4)3溶液中SO42﹣的物质的量浓度为 mol/L;
(3)标准状况下,36g H2和O2组成的混合气体的体积是67.2L。求这种混合气体中H2和O2的体积
比 ,混合气体的平均摩尔质量为 ;
(4)市售盐酸试剂中溶质的质量分数为36.5%,密度为1.18g/ml,该盐酸的物质的量浓度是 mol/L 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
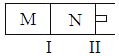
A.若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B.若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C.若x<3,C的平衡浓度关系为:c(M)>c(N)
D.x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】73.0g HCl气体中含有_______个分子、________个原子、______个质子、______个电子,标况下体积约为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W原子序数依次增大,X原子最外层电子数是其电子层数的3倍,Y在短周期主族元素中原子半径最大, Z与X同主族。下列说法正确的是
A.原子半径:Y<Z<W
B.气态氢化物的稳定性:X<W
C.最高价氧化物的水化物的酸性:Z<W
D.X和Y只能形成一种离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com