
【题目】某固体混合物中可能含有: K+、 Na+、Clˉ、CO32ˉ、SO42ˉ等离子,将该固体溶解所得到的溶液进行如下实验:
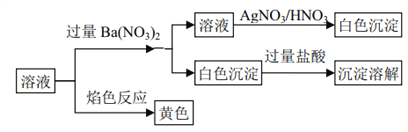
下列说法正确的是
A. 该混合物一定是K2CO3和 NaCl B. 该混合物可能是 Na2CO3和 KCl
C. 该混合物一定是Na2CO3和 NaCl D. 该混合物可能是 Na2SO4和 Na2CO3
【答案】B
【解析】焰色反应呈黄色,说明一定含有Na+;加入过量硝酸钡生成能溶于盐酸的沉淀,原溶液一定含有CO32ˉ,一定不含SO42ˉ;加入过量硝酸钡后的滤液中加入硝酸酸化的硝酸银,生成白色沉淀,则原溶液一定含有Clˉ;根据以上分析,一定含有Na+、Clˉ、CO32ˉ,一定不含SO42ˉ,可能含有K+;所以该混合物可能是 Na2CO3、 KCl或K2CO3、NaCl,故B正确。
【题型】单选题
【结束】
20
【题目】一定量的钠和铝的混合物与足量的水充分反应,没有金属剩余,收到2.24L气体,下列说法一定正确的是
A. 所得气体为氢气 B. 所得气体的物质的量为 0.1 mol
C. 上述过程只发生一个化学反应 D. 所得溶液中只有一种溶质
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将水分解制得氢气的一种工业方法是“硫﹣碘循环法”,依次涉及下列三步反应:
I.SO2+2H2O+I2=H2SO4+2HI
II.2HI(g)H2(g)+I2(g)
III.2H2SO4=2SO2+O2+2H2O
(1)一定温度下,向5L恒容密闭容器中加入1molHI,发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=___。相同温度下,若起始加入的HI改为2mol,反应达平衡时H2的量为___mol。
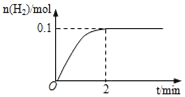
(2)分析上述反应,下列判断错误的是___(填写选项编号,只有一个正确选项)。
a.三步反应均为氧化还原反应
b.循环过程中产生1molH2,同时产生1molO2
c.在整个分解水的过程中SO2和I2相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A.CO全部转化为乙醇B.正反应和逆反应的化学反应速率均为0
C.CO和H2以1∶2的物质的量之比反应生成乙醇D.反应体系中乙醇的物质的量浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列有关实验装置进行的相应实验中,能达到实验目的的是
A.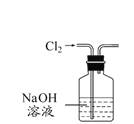 所示装置除去Cl2中含有的少量HCl
所示装置除去Cl2中含有的少量HCl
B. 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 所示装置制取少量纯净的CO2气体
所示装置制取少量纯净的CO2气体
D.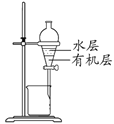 所示装置分离CCl4萃取碘水后已分层的有机层和水层
所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“NaCl+CO2+NH3+H2O→NaHCO3↓+NH4Cl”是侯氏制碱法的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。错误的是
A. 甲同学说:该条件下NaHCO3的溶解度较小
B. 乙同学说: NaHCO3不是纯碱
C. 丙同学说:析出 NaHCO3固体后的溶液中只含氯化铵
D. 丁同学说:该反应是在饱和食盐水中先通入氨气,再通入二氧化碳
【答案】C
【解析】反应中只有碳酸氢钠沉淀生成,所以该条件下NaHCO3的溶解度较小,故A正确;纯碱是Na2CO3,NaHCO3是小苏打,故B正确;析出 NaHCO3固体后的溶液仍是NaHCO3的饱和溶液,含氯化铵、NaHCO3等,故C错误;在饱和食盐水中先通入氨气使溶液呈碱性,再通入二氧化碳,增大二氧化碳的溶解度,故D正确。
【题型】单选题
【结束】
18
【题目】NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1mol OH- 含有的电子数目为 NA
B. 1L 1 mol·L-1 Na2CO3 溶液中含有的 CO32-数目为 NA
C. 0.5mol 苯中含有碳碳双键的数目为 1.5NA
D. 24 克 O3 中氧原子的数目为 1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮的变化关系图如下:
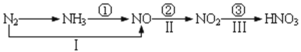
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线ⅠⅡ Ⅲ是雷电固氮生成硝酸的主要途径
C.氮气可在足量的氧气中通过一步反应生成NO2
D.上述所有反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的装置如图所示:

(1)实验原理:______________。
(2)实验装置:气体制备型化学实验装置的设计,要将化学反应原理、气体净化、收集和尾气处理等结合起来。
①填写装置中试剂名称,C______________,D____________,F__________。
②其中C的作用是除去氯气中的____________;D的作用是除去氯气中的____________。
③该装置中收集氯气使用的是________,还可用排__________的方法,原因是_____________。
④其中F的作用是_____________。
⑤检验氯气是否收集满可用__________放在集气瓶口,若试纸______,则证明已集满。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是重要的氨化剂,在潮湿的空气中能转化为碳酸铵,受热易分解、易被氧化。实验小组对氨基甲酸铵的性质进行了如下探究。请回答下列问题:
(1)氨基甲酸铵在潮湿的空气中转化为碳酸铵的化学方程式为____________________________。
(2)用下图装置探究氨基甲酸铵的分解产物(夹持装置略去,下同)。

①点燃A处的酒精灯之前,需先打开k,向装置中通入一段时间的N2,目的为_________________。
②仪器B的名称为_________________。
③装置D的作用为________________________________________________________。
④能证明分解产物中有NH3的现象为_________________________________________。
⑤试剂A用于检验分解产物中的CO2,该试剂的名称为_______________________。
(3)已知:CuO高温能分解为Cu2O和O2。若用上述装置和下列部分装置进一步检验分解产物中是否有CO,装置E后应依次连接_________________(按从左到右的连接顺序填选项字母)。
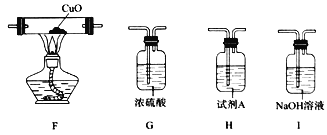
(4)通过实验得出结论:氨基甲酸铵受热分解为NH3和CO2。该反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种天然黄铜矿主要成分为CuFeS2 (含SiO2),为了测定该黄铜矿的纯度,某同学设计了如图1实验:
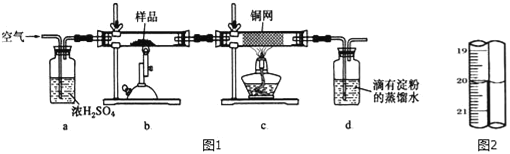
称取研细的黄铜矿样品1.150g煅烧,生成Cu、Fe2O3、FeO和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.01mo1/L标准碘溶液进行滴定,初读数为0.01mL,末读数如图2所示.
完成下列填空:
(1)实验中称量样品所需定量仪器为_____.
(2)装置c的作用是_____.
(3)上述反应结束后,仍需通一段时间的空气,其目的是_____.
(4)滴定时,标准碘溶液所耗体积为_____mL.用化学方程式表示滴定的原理:_____.
(5)计算该黄铜矿的纯度_____.
(6)工业上利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.选用提供的试剂,设计实验验证炉渣中含有FeO.提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液,所选试剂为_____.证明炉渣中含有FeO的实验现象为:_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com