
| A. | 0.15mol•L-1 | B. | 0.2mol•L-1 | C. | 0.3mol•L-1 | D. | 0.4mol•L-1? |
科目:高中化学 来源: 题型:填空题
| t/min | 1 | 4 | 8 | 11 |
| n(H2)mol | 6 | 2.6 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
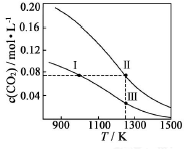 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)>3P总(状态Ⅰ) | |
| C. | 体系中c(CO2):c(CO2,状态Ⅱ)<3c(CO2,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序为③>②>① | |
| B. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积和混合,其离子浓度不可能是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=13的Ba(OH)2溶液与pH=1的盐酸等体积混合,混合溶液的 pH>7 | |
| D. | pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 物质 | KNO3溶液 | CO2 | 水 | 乙醇 |
| 杂质 | KOH | H2O(g) | 溴 | 水 |
| 除杂试剂 | FeCl3溶液 | 浓硫酸 | 酒精 | 生石灰 |
| 除杂装置 | 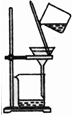 | 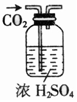 | 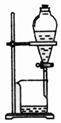 | 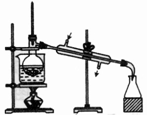 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com