
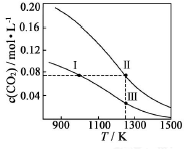
 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)>3P总(状态Ⅰ) | |
| C. | 体系中c(CO2):c(CO2,状态Ⅱ)<3c(CO2,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
分析 A.由气体的化学计量数增大可知△S,由图中温度高平衡时c(CO2)小可知△H;
B.分别加入0.1molCO2和0.3molCO2,曲线I为加入0.1molCO2,曲线II为加入0.2molCO2,加压CO2(g)+C(s)?2CO(g)平衡逆向移动;
C.状态II、状态Ⅲ的温度相同,状态II看作先加入0.1molCO2,与状态Ⅲ平衡时CO的浓度相同,再加入0.2molCO2,若平衡不移动,Ⅱ状态CO的浓度等于3倍Ⅲ,但再充入CO2,相当增大压强,平衡左移动,消耗CO;
D.状态I、状态Ⅲ的温度不同,温度高反应速率快.
解答 解:A.由气体的化学计量数增大可知△S>0,由图中温度高平衡时c(CO2)小,则升高温度平衡正向移动,可知△H>0,故A错误;
B.分别加入0.1molCO2和0.3molCO2,曲线I为加入0.1molCO2,曲线II为加入0.2molCO2,若平衡不移动,体系的总压强为P总(状态Ⅱ)=2P总(状态Ⅰ),但加压CO2(g)+C(s)?2CO(g)平衡逆向移动,为使c(CO2)相同,则加热使平衡正向移动,则体系的总压强为P总(状态Ⅱ)>2P总(状态Ⅰ),所以体系的总压强P总:P总(状态Ⅱ)>3P总(状态Ⅰ),故B正确;
C.状态II、状态Ⅲ的温度相同,状态II看作先加入0.1molCO2,与状态Ⅲ平衡时CO的浓度相同,再加入0.2molCO2,若平衡不移动,Ⅱ状态CO的浓度等于3倍Ⅲ,但再充入CO2,相当增大压强,平衡左移,消耗CO,则c(CO,状态Ⅱ)<3c(CO,状态Ⅲ),故C正确;
D.状态I、状态Ⅲ的温度不同,温度高反应速率快,则逆反应速率为V逆(状态Ⅰ)<V逆(状态Ⅲ),故D错误;
故选BC.
点评 本题考查化学平衡及平衡的建立,为高频考点,题目难度中等,明确平衡移动的影响因素、图象分析为解答的关键,选项BC为解答的难点,试题培养了学生的分析能力及灵活应用能力.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO3)/mol | n(O2)/mol |
| 0 | 2.0 | 0 |
| 2 | 0.8 | |
| 4 | 0.6 | |
| 6 | 1.8 | 1.1 |
| A. | 0~2 min平均速率v(SO2)=0.6 mol•L-1•min-1 | |
| B. | 4 min后,平衡移动的原因可能是减压 | |
| C. | 若升高温度后的平衡常数的值为1.0,则该正反应为吸热反应 | |
| D. | 若起始时容器中SO3的物质的量改为1.0 mol,则平衡时n(SO2)=0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低温、低压 | B. | 低温、高压 | C. | 高温、高压 | D. | 高温、低压 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 电池的总反应是 2C4H10+13O2=8CO2+10H2O | |
| C. | 通入空气的一极是正极,电极反应为 O2+4e-=2O2- | |
| D. | 通入丁烷的一极是负极,电极反应为 C4H10+13O2-+26e-=4CO2+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁可用来制造红色油漆和涂料 | |
| B. | 生铁、普通钢和不锈钢中的含碳量依次减小 | |
| C. | 硅胶可用作实验室和袋装食品、瓶装药品等的干燥剂 | |
| D. | 硅是生产光纤制品的基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol•L-1 | B. | 0.2mol•L-1 | C. | 0.3mol•L-1 | D. | 0.4mol•L-1? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com