
【题目】某温度下,在2L容器中,3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t1 min时到达平衡,如图所示:

(1)①该反应的化学方程式是________。
②在t1 min时,该反应达到了_________状态,下列可作为判断反应已达到该状态的是________。
A. X、Y、Z的反应速率相等 B. X、Y的反应速率比为2:3
C. 生成3mol Y的同时生成1mol Z D. 生成1mol Z的同时生成2mol X
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则至t1 min时,该反应吸收的热量为____________;
②在此t1 min时间内,用H2表示反应的平均速率v(H2)为________。
【答案】2X![]() 3Y+Z 平衡 D 36.8kJ
3Y+Z 平衡 D 36.8kJ ![]() molL-1min-1
molL-1min-1
【解析】
(1)①根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比分析书写方程式;②化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,据此分析判断;
(2)①根据NH3分解的物质的量,结合反应热计算至t1min时,该反应吸收的热量;②根据c=![]() 计算反应速率。
计算反应速率。
(1)①由图象可以看出,反应中X的物质的量减小,Y、Z的物质的量增多,则X为反应物,Y、Z为生成物,一段时间后物质的量不再变化,说明该反应为可逆反应,且△n(X)∶△n(Y)∶△n(Z)=0.8mol∶1.2mol∶0.4mol=2∶3∶1,则反应的化学方程式为:2X![]() 3Y+Z,故答案为:2X
3Y+Z,故答案为:2X![]() 3Y+Z;
3Y+Z;
②在t1min时,各物质的物质的量不再变化,说明达到平衡状态;A.由方程式可以看出,达到平衡时X、Y、Z的反应速率不相等,X、Y、Z的反应速率相等,说明不是平衡状态,故A错误;B.无论是否达到平衡状态,X、Y的反应速率比都为2∶3,故B错误;C.无论是否达到平衡状态,生成3molY的同时一定生成1molZ,故C错误;D.生成1molZ的同时生成2molX,说明正、逆反应速率相等,说明达到平衡状态,故D正确;故答案为:平衡;D;
(2)①t1min时,消耗NH3的物质的量为0.8mol,则吸收的能量为:0.8mol×46kJ/mol=36.8kJ,故答案为:36.8kJ;
②H2的反应曲线为Y,则在此t1min时间内,用H2表示反应的平均速率v(H2)= =
=![]() molL-1min-1,故答案为:
molL-1min-1,故答案为:![]() molL-1min-1。
molL-1min-1。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】(NH4)2Fe(SO4)26H2O(M=392g/mol)又称摩尔盐,简称FAS,它是浅蓝色绿色晶体,可溶于水,难溶于水乙醇。某小组利用工业废铁屑进行下列实验。请按要求回答下列问题:
Ⅰ. FAS的制取。流程如下:

(1)步骤①加热的目的是_________________________。
(2)步骤②必须在剩余少量铁屑时进行过滤,其原因是(用离子方程式表示): ______________。
Ⅱ.NH4+含量的测定。装置如图所示:

实验步骤:①称取FAS样品a g,加水溶解后,将溶液注入Y中
②量取b mL c1 mol/LH2SO4溶液于Z中
③向Y加入足量NaOH浓溶液,充分反应后通入气体N2,加热(假设氨完全蒸出),蒸氨结束后取下Z。
④用c2mol/LNaOH标准溶液滴定Z中过量的硫酸,滴定终点时消耗d mLNaOH标准溶液。
(3)仪器X的名称______________;N2的电子式为______________。
(4)步骤③蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行处理的操作是__________________;NH4+质量百分含量为(用代数式表示)__________________。
Ⅲ. FAS纯度的测定。称取FAS m g样品配制成500 mL待测溶液。分别取20.00mL待测溶液,进行如下方案实验:
(5)方案一:用0.01000mol/L的酸性KMnO4溶液进行滴定。滴定过程中需用到的仪器中(填图中序号)_________。滴定中反应的离子方程式为____________________。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
(6)方案二: 待测液 ![]() 固体n g ;则FAS的质量百分含量为(用代数式表示)_____________________________。
固体n g ;则FAS的质量百分含量为(用代数式表示)_____________________________。
(7)方案一、二实验操作均正确,却发现方案一测定结果总是小于方案二的,其可能的原因是_______________;为验证该猜测正确,设计后续实验操作为_________________,现象为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组探究实验室中制备 Cl2 的过程,为证明过程中有水蒸气和 HCl 挥发出来,同时证明Cl2的某些性质,甲同学设计了如下图所示的实验装置,按要求回答问题。

(1)用浓盐酸与足量的 MnO2 反应制Cl2 的化学反应方程式_____。
(2)①装置 B 中盛放的试剂名称为_____,作用是_____,现象是_____。
②装置 D 和E 中出现的不同现象说明的问题是_________。
③装置 F 的作用是_____。
④写出装置G 中发生反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是
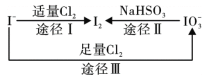
A. 氧化性的强弱顺序为:Cl2 >IO3- >I2
B. 一定条件下, I-与IO3-反应可能生成I2
C. 途径Ⅱ中若生成1mol I2,消耗4mol NaHSO3
D. 向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液不一定变为蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)非金属性最强的元素是__________;(用元素符号回答,下同)
(2)化学性质最不活泼的单质是__________;
(3)④、⑤、⑥、⑦中形成的简单离子半径由大到小的顺序为是__________;
(4)某原子结构示意图为![]() ,其对应的元素符号是__________;
,其对应的元素符号是__________;
(5)H2S和HCl中,热稳定性较强的是__________;
(6)NaOH、Mg(OH)2、Al(OH)3中,碱性最强的是__________;属于两性氢氧化物的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有 Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法正确的是

A. 若原溶液中不存在 Na+,则 c(Cl-)<0.1molL﹣1
B. 原溶液可能存在 Cl- 和 Na+
C. 原溶液中 c(CO32-)是 0.01molL﹣1
D. 原溶液一定存在 CO32-和SO42-,一定不存在 Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液100mL,其中可能含Fe3+、Al3+、Na+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示。

请回答下列问题:
(1)焰色反应是_____(填“物理”或“化学”)变化;实验③中产生的无色无味气体是_____(填化学式)。
(2)原溶液中一定存在的离子有______________,可能存在的离子有_____________________,一定不存在的离子有______________(写化学式)。
(3)若溶液中K+物质的量为0.04 mol,则c(Na+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。

请回答下列问题:
(1)写出A的结构简式__________,B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,____________________;
④____________________,____________________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol E__________,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是

A. 金属性:甲>乙>丁
B. 乙的单质在空气中燃烧生成只含离子键的化合物
C. 原子半径:辛>己>戊
D. 丙与庚的原子核外电子数相差3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com